Chronické ochorenia pečene sú spojené s komplexnými zmenami v hemostáze a v hemograme pacienta. Aj keď uvedené zmeny nepatria medzi primárne hematologické ochorenia, takmer každý hematológ príde s touto problematikou do kontaktu, či už v rámci diferenciálnej diagnostiky, alebo v rámci konzultácie ohľadom prípravy pred invazívnym výkonom. V tejto súvislosti je preto významné informovať odbornú verejnosť o novom – dalo by sa povedať revolučnom – pohľade na hemostázu pri ochoreniach pečene.
Úvod
Pečeň zohráva dôležitú úlohu v hemostatickom systéme, čo vyplýva zo skutočnosti, že väčšina bielkovín hemostatického systému je tvorená v hepatocytoch. Z toho vyplýva, že ochorenia pečene vedúce k vzniku pečeňovej fibrózy a neskôr cirhózy znamenajú rozvoj zmien v celom hemostatickom systéme a zasahujú primárnu hemostázu, sekundárnu hemostázu aj zmeny vo fibrinolytickom systéme. Tieto zmeny boli celé desaťročia tradične spájané so zvýšenou obavou z krvácania pri invazívnych výkonoch, pacienti podstupovali často náročnú predoperačnú prípravu. Uvedené obavy vyplývali z výsledkov konvenčných koagulačných vyšetrení s typickým predĺžením protrombínového času (PT) aj aktivovaného parciálneho tromboplastínového času (aPTT) a tiež z často prítomnej trombocytopénie aj z krvácavých prejavov pozorovaných u pacientov s cirhózou pečene.
Dnes vieme, že tradičné vnímanie hemostázy pri cirhóze pečene je prekonané novým pohľadom, ktorý hovorí o hemostáze v rovnováhe, v anglickej literatúre označovanej ako „rebalanced hemostasis“. To, že je hemostáza pri cirhóze pečene „rebalansovaná“ vyplýva zo skutočnosti, že poškodením hepatocytov sa neznižuje len syntéza väčšiny koagulačných faktorov, ale zároveň sa znižuje syntéza inhibítorov krvného zrážania. Naopak, aktivita FVIII a von Willebrandovho faktora je vysoká. Na úrovni fibrinolytického systému sú taktiež zasiahnuté pro- aj antifibrinolytické procesy, ktorých výsledkom môže byť rovnováha aj na úrovni fibrinolýzy. Keďže ide o komplexné zmeny v celom hemostatickom systéme, nie je možné ich obsiahnuť meraním rutinne používaných koagulačných vyšetrení ako je PT a aPTT.
Zmeny v hemostáze u pacientov s chronickým ochorením pečene
Zmeny v hemostatickom systéme podmienené chronickým ochorením pečene vyplývajú zo zníženej funkcie hepatocytu, čo vedie k zníženej syntéze koagulačných faktorov aj prirodzených inhibítorov krvného zrážania (antitrombín, proteín C, proteín S) a spomaľuje sa odbúravanie aktivovaných koagulačných faktorov. Znížená je syntéza niektorých proteínov fibrinolytického systému, naopak v cirkulácii môže byť nadbytok tkanivového aktivátora plazminogénu (tPA) v dôsledku jeho spomaleného odbúrania v pečeni. Typickým prejavom býva trombocytopénia v dôsledku hypersplenizmu, ako aj v dôsledku zníženej tvorby trombopoetínu v pečeni, môže sa kombinovať s imúnne sprostredkovanou trombocytopéniou u pacientov s autoimúnnym ochorením pečene či vírusovými hepatitídami. V literatúre bežne popisovaná trombocytopatia je diskutovaná. In vitro sa dokazuje zachovaná adhézia trombocytov v dôsledku zvýšenej hladiny von Willebrandovho faktora (vWF), ktorý umožňuje adhéziu krvných doštičiek na cievnu stenu (1, 2, 3). Rovnako diskutovaná je aj tradične popisovaná hyperfibrinolýza spájaná so zvýšeným rizikom krvácania u pacientov s chronickým ochorením pečene. Spoľahlivo dokázať hyperfibrinolýzu nie je jednoduché, keďže v bežnej praxi chýbajú dostatočne objektívne laboratórne vyšetrenia zamerané na komplexné hodnotenie fibrinolytického procesu, zohľadňujúce zmeny na úrovni profibrinolytických aj antifibrinolytických faktorov. Zdá sa, že aj v rámci fibrinolytického systému je vytvorená nová rovnováha spôsobená alteráciou oboch jej zložiek (1, 2, 3, 6). Známe sú zmeny vo funkcii koagulačných faktorov, predovšetkým dysfibrinogenémia.
Na druhej strane, u pacientov s chronickým ochorením pečene pozorujeme významné zvýšenie niektorých koagulačných faktorov, ktoré nie sú syntetizované v hepatocytoch. Ide predovšetkým o zvýšenie hladiny FVIII a von Willebrandovho faktora. Príčina ich zvýšenia je multifaktoriálna (2, 15). Pokles hladiny FVIII u pacientov s chronickým ochorením pečene môže upozorňovať na vývoj diseminovanej intravaskulárnej koagulácie (15). Prehľad zmien v hemostatickom systéme je uvedený v Tabuľke č. 1.
Vyššie uvedené zmeny v hemostatickom systéme predstavujú dynamický komplex vzájomných interakcií. Laboratórne testy používané bežne v praxi (PT, aPTT) odzrkadľujú predovšetkým aktivitu prokoagulačných faktorov a merajú len čas do začatia koagulačného procesu. Javia sa ako nedostatočné, keďže nedokážu obsiahnuť komplexné zmeny v hemostatickom systéme pri cirhóze pečene.
Testy schopné monitorovať celkovú koagulačnú kapacitu sa nazývajú globálne testy a zaraďuje sa k nim tromboelastografia a test generácie trombínu. Uvedené testy sú schopné merať priebeh celého procesu zrážania krvi, pričom odrážajú pomer medzi pôsobením prokoagulačných a antikoagulačných faktorov. Sú tak schopné odhaliť sklon k hypo- alebo hyperkoagulačnému stavu (10).
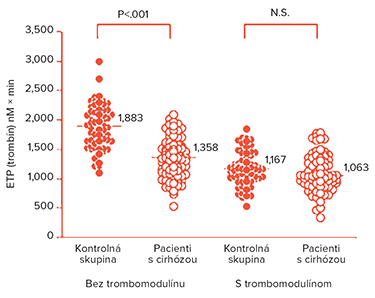
Práve test generácie trombínu (TGT) meraním endogénneho trombínového potenciálu (ETP) ukázal, že pacienti s chronickým ochorením pečene sú schopní v kontraste s predĺžením PT aj aPTT generovať trombín rovnako ako zdravá populácia (5). V kontexte tohto poznatku preto môžeme hovoriť o vyváženej hemostáze („rebalanced hemostasis“) u pacientov s chronickým ochorením pečene a to v dôsledku alterácie pro- aj antihemostatických procesov, a to na úrovni primárnej hemostázy, sekundárnej hemostázy aj v rámci fibrinolytického systému. Klinicky významným poznaním je, že stupeň trombocytopénie je významnejší pri generácii trombínu než samotná koncentrácia koagulačných faktorov (5).
Uvedená hemostazeologická rovnováha pri cirhóze pečene je však fragilná a má menšie kompenzačné rezervy. Môže sa vplyvom pridružených zdravotných okolností ľahko vychýliť na stranu krvácania aj na stranu trombózy (Obrázok č. 1) (1). Faktom ostáva, že 20 % pacientov s cirhózou pečene v súvislosti s invazívnym výkonom krváca (19) a druhým faktom je to, že pacienti s cirhózou pečene majú aj trombotické komplikácie, ktoré vyplývajú okrem iného aj z hyperkoagulačného stavu, do ktorého cirhóza pečene ústi.
Krvácavé situácie pri chronických ochoreniach pečene
Napriek tomu, že pri akútnom zlyhaní pečene býva PT predĺžený oveľa významnejšie (v dôsledku ťažšieho deficitu koagulačných faktorov) než pri chronickom zlyhaní, spontánne krvácania sa popisujú menej než v 5 % (1). Jedno z najvýznamnejších krvácaní je krvácanie z ezofageálnych varixov, ktoré je podmienené skôr lokálnymi cievnymi abnormalitami a zvýšením tlaku v splanchnickej cirkulácii než zmenami v hemostatickom systéme.
Najčastejšie sa obávame krvácania v súvislosti s invazívnymi výkonmi, ako sú napríklad zavedenie centrálneho venózneho katétra, zubné extrakcie či rôzne operačné výkony. Tu treba zdôrazniť, že hodnota PT a aPTT nie je prediktorom krvácania a korekcia týchto testov nezaručuje, že pacient nebude krvácať. Z hľadiska hemostazeologickej prípravy sa pred invazívnym výkonom odporúča stratifikovať rizikových pacientov (anamnéza krvácania či trombotickej príhody) a podľa stupňa invazivity výkonu (výkon spojený s najvyšším stupňom invazivity) je vhodné indikovať globálne koagulačné vyšetrenie, ktorým je v našich podmienkach čoraz viac dostupná tromboelastografia (TEG) (1). Existujú centrá, ktoré v praxi používajú manažment „wait and see“,teda čakaj a sleduj. To znamená, že preventívne nepodávajú čerstvo zmrazenú plazmu (ČZP) či koncentráty koagulačných faktorov (KKF). Ich použitie indikujú len v prípade krvácania v súvislosti s invazívnym výkonom (6). Uvedený postup sa javí ako bezpečný a efektívny z liečebného aj ekonomického hľadiska. Redukovaná príprava pred invazívnym výkonom nevedie k zvýšenému riziku krvácania (19). Neprimeranou aplikáciou ČZP môžeme dosiahnuť opačný efekt, ako si želáme, a to zvýšenie venózneho tlaku a portálnej hypertenzie, čo významne prispieva ku krvácaniu pri invazívnom výkone. Neadekvátnou aplikáciou KKF môžeme narušiť hemostazeologickú rovnováhu pacienta smerom k hyperkoagulačnému stavu (1, 3, 6). Aplikácia rekombinantného FVIIa nevedie k zastaveniu krvácania z ezofageálnych varixov, neosvedčila sa ani pri hepatektómiách a neodporúča sa preventívne podávať pri uvedených výkonoch (3). Stupeň trombocytopénie sa javí ako klinicky významný a podanie trombocytového koncentrátu je namieste s ohľadom na závažnosť trombocytopénie a rizikovosť výkonu. In vitro sa javí zachovaná generácia trombínu pri počte trombocytov 50 – 60 x 109/l (3).
Dôvody, prečo pacienti s chronickým ochorením pečene krvácajú, vyplývajú z narušenia menej stabilnej rovnováhy v hemostatickom systéme. Posun tejto rovnováhy smerom ku krvácavých prejavom môže spustiť renálna insuficiencia či bakteriálna infekcia, ktoré sú považované za výrazne rizikové situácie pre krvácanie. Ďalšími príčinami krvácania bývajú portálna hypertenzia a endotelová dysfunkcia (1, 3). Uvádza sa, že portálna hypertenzia je hlavný rizikový faktor krvácania u pacientov s cirhózou pečene (18).
Treba zdôrazniť, že manažment krvácania u pacientov s chronickým ochorením pečene je náročný, neexistujú všeobecné odborné odporúčania, potreba profylaktického podávania ČZP a KKF je diskutovaná a je odporúčaná rozvážnosť a umiernenosť v ich aplikácii (1, 3, 6).
Trombotické situácie pri chronických ochoreniach pečene
Tradičné názory, že pacienti s chronickým ochorením pečene majú sklon k hypokoagulácii v dôsledku predĺženia PT a aPTT, že sú „auto-antikoagulovaní“ a tak chránení pred trombotickými komplikáciami, sa stáva mýtom. Výsledky klinických štúdií, nové poznatky o hemostáze a skúsenosti z praxe poukazujú, že pacienti s cirhózou pečene majú trombotické príhody. Ako je vyššie uvedené, progredujúca cirhóza pečene vedie časom k manifestácii protrombotického stavu (18). V kombinácii s ďalšími vrodenými či získanými protrombotickými stavmi môžu tieto okolnosti vyústiť do trombotických situácií.
1. Venózny trombembolizmus (VTE)
Incidencia VTE u pacientov s chronickým ochorením pečene sa udáva ako pomerne variabilná, 0, 5 % – 1,87 – 6,3 % (3). Pri hodnotení relatívneho rizika pre VTE u pacientov s chronickým ochorením pečene nachádzame rozporuplné závery. (3). V roku 2009 však bola publikovaná veľká populačná štúdia poukazujúca na približne dvojnásobne vyššie riziko vzniku VTE u pacientov s cirhotickým aj necirhotickým ochorením pečene v porovnaní so zdravou populáciou. Zaujímavé je, že sa nepozoroval rozdiel medzi cirhotickým a necirhotickým ochorením pečene z pohľadu rizika pre VTE (16). NAFLD bola vyhodnotená ako rizikový faktor pre VTE (3, 16).
Pacienti s chronickým ochorením pečene nie sú chránení pred vznikom trombózy v žilovom systéme a pred následnou embolizáciou. Je potrebné si to uvedomiť hlavne v súvislosti so všeobecne známymi rizikovými faktormi ako je imobilita, operačné výkony, dlhodobé hospitalizácie, prítomnosť onkologického ochorenia či výskyt vrodených trombofilných stavov.
2. Trombóza vena portae (TVP)
Výskyt TVP u pacientov s cirhózou pečene sa popisuje rozdielne, v závislosti od vyšetrovacej metódy. Staršie angiografické štúdie popisujú výskyt TVP 0,6 %, ultrasonografické vyšetrenia 4,4 %, vyšetrenia počítačovou tomografiou či magnetickou rezonanciou 10 – 12 %. Výskyt TVP u pacientov s cirhózou pečene čakajúcich na transplantáciu sa udáva 15 % a podľa pitevných nálezov explantovaných pečení sa udáva až 36 %. (7).
Spomalený prietok krvi vo vena portae (VP) v dôsledku prestavby pečeňového parenchýmu pri cirhóze pečene so vznikom vaskulárnej rezistencie sa považuje za hlavný rizikový faktor TVP (6, 7, 8). Stagnujúca krv vo VP a následná hypoxia spôsobujú aktiváciu endotelových buniek a iniciujú tvorbu krvnej zrazeniny (7). Z vrodených trombofílií sa ako významná javí asociácia TVP a prítomnosť mutácie v géne pre protrombín G20210A (1, 6, 7, 8, 11). Prítomnosť mutácie protrombínu G20210A pri TVP u cirhotických pacientov sa popisuje v 34,8 % prípadov, kým výskyt mutácie FV Leiden v 13 % (13). V súvislosti s TVP pri cirhóze pečene sa často popisuje frekventovaný výskyt mutácie MTHFR C677T v homozygotnom stave a to 43,5 %(13). Je potrebné zdôrazniť, že mutácia MTHFR C677T je frekventovaná v populácii a klinický význam nadobúda len pri dokázanej zvýšenej hladine homocysteínu.
Myeloproliferatívne neoplázie (MPN) sa spájajú so zvýšeným rizikom trombotických komplikácií, obzvlášť atypicky lokalizovaných. Prítomnosť MPN pri necirhotických TVP, bez prejavov inej malignity, sa udáva v 37 % prípadov (9). Pri TVP u pacientov s cirhózou pečene sa zisťuje izolovaná prítomnosť JAK2 V617F mutácie asociovanej s MPN v rozsahu 17 – 35 %, bez iných klinických prejavov MPN. Skutočná prevalencia MPN pri TVP u cirhotických pacientov nie je známa (12).
Ďalšími rizikovými faktormi vzniku TVP pri chronickom ochorení pečene sú abdominálne zápaly (divertikulitída, pankreatitída, cholangoitída, zápalové ochorenia čreva), z operačných výkonov predovšetkým splenektómia (7, 8). Incidencia TVP pri hepatocelulárnom karcinóme je 44 %(9), ide teda o významný rizikový faktor. Výskyt TVP však narastá so stupňom poškodenia pečene hodnoteného podľa Childovho-Pughovho skóre (3, 12), čo koreluje s poznatkom, že s progredujúcou cirhózou sa vyvíja protrombotický stav.
TVP vedie k zvýšenému riziku nekontrolovaného krvácania z ezofageálnych varixov, jej progresia do vena mesenterica superior sa spája s rizikom črevnej ischémie a črevného infarktu, intrahepatálna progresia spôsobuje apoptózu hepatocytov a prispieva k progresii fibrózy pečene (3, 6). TVP zhoršuje mortalitu v 1. roku po transplantácii pečene (3, 4, 7, 8), nie je však kontraindikáciou pre tento výkon. Závažné klinické následky TVP sú dôvodom, prečo sa posledné roky diskutuje o potrebe jej optimálnej liečby.
3. Artériové oklúzie pri ochorení pečene
Prekonaným sa stáva aj názor, že pacienti s chronickým ochorením pečene majú vzácny výskyt kardiovaskulárnych uzáverov. Pacienti s NAFLD majú dvojnásobne zvýšené riziko koronárnych príhod v porovnaní so zdravou populáciou (4, 6, 14). Etiologicky sa uplatňuje súhra rizikových faktorov, ako sú dyslipidémia, diabetes, hypertenzia a metabolický syndróm. Pacienti s NAFLD trpia zvyčajne obezitou a tá je asociovaná so spomalenou fibrinolýzou, s určitým stupňom rezistencie trombocytov voči antiagregačnej liečbe a so zvýšenou aktiváciou krvných doštičiek (6). Podobný záver bol zistený aj pri cirhóze podmienenej alkoholovým poškodením pečene (6).
S narastajúcim počtom pacientov s NAFLD narastá aj počet pacientov s koronárnym či cerebrovaskulárnym uzáverom s potrebou antiagregačnej liečby, zvlášť pri intervenčnej liečbe so zavedením stentu do koronárnych artérií.
4. Pečeňová fibróza
Chronické ochorenia pečene vedú postupne k rozvoju pečeňovej fibrózy, ktorá vzniká interakciou genetických a environmentálnych faktorov. Jedným z nich je aj koagulácia. Existujú dve teórie, ktoré popisujú vzťah medzi fibrózou pečene a protrombotickým stavom. Prvá teória sa opiera o prítomnosť mikroembolov vo vetvách vena portae v dôsledku jej trombózy. Mikroembolizácie vedú k lokálnej ischémii, nekróze a k následnej fibróze pečeňového parenchýmu.
Druhá teória sa zakladá na priamej aktivácii hviezdicovitých buniek trombínom a aktivovaným FX (FXa) prostredníctvom skupiny receptorov PAR (protease activated receptor). Expresia PAR na hviezdicovitých bunkách sa zvyšuje so stupňom poškodenia pečene. Hviezdicovité bunky sa po aktivácii transformujú na bunky podobné myofibroblastom a sú zodpovedné za reparačné procesy v poškodenej pečeni, ktorých výsledkom je fibróza. Túto teóriu podporujú zistenia, že pacienti s vírusovou hepatitídou C (HCV) a súčasne s prítomnou mutáciou FV Leiden (vrodený trombofilný stav) majú 3-násobne vyššie riziko rýchlejšej progresie fibrózy, kým u pacientov s hemofíliou (vrodená krvácavá porucha) a HCV je progresia fibrózy pomalšia (1, 2, 3, 4). Podávanie PAR1 antagonistov hlodavcom vedie k spomaleniu progresie fibrózy. Viaceré práce poukazujú na pomalší priebeh chemicky indukovanej fibrózy u hlodavcov pri podávaní nízkomolekulového heparínu (LMWH) alebo antagonistov vitamínu K (VKA) (2, 3). Uvedené pozorovania poukazujú na priamu súvislosť medzi generáciou trombínu a progresiou fibrózy.
E. Villa so spoluautormi publikoval súvislosť dlhodobého podávania LMWH v profylaktickej dávke pacientom s cirhózou pečene so znížením incidencie trombózy VP, ale aj s predĺžením času do dekompenzácie cirhózy (20). Prehodnotiť efekt antitrombotickej liečby na vývoj fibrózy u pacientov s chronickým ochorením pečene je cieľom klinických štúdií (2, 4).
Záver
Pacienti s cirhózou pečene majú zachovanú generáciu trombínu, ich hemostáza je v rovnováhe ako v zdravej populácii, s progresiou ochorenia môže dokonca vznikať sklon k protrombotickému stavu. V kontexte nových poznatkov začína byť cirhóza označovaná ako trombofilný stav. Pacienti s cirhózou nie sú chránení pred vznikom trombotických príhod v arteriálnom ani žilovom systéme. Osobitnú pozornosť vyžaduje trombóza VP, keďže má závažné klinické následky. Významným sa stáva aj poznatok, že progresia fibrózy pečene môže súvisieť s hyperkoagulačným stavom navodeným zmenami v hemostatickom systéme pri progredujúcom chronickom ochorení pečene.
Tradičný názor, že pacienti s cirhózou pečene v dôsledku zmien v hemostáze krvácajú, sa stáva prekonanou dogmou. Krvácavé prejavy súvisia predovšetkým s rozvojom renálnej insuficiencie, bakteriálnej infekcie a portálnej hypertenzie. Otázka, ako manažovať prípravu pacienta v súvislosti s rizikom krvácania, nie je jednoznačne zodpovedaná. Je však zrejmé, že intenzívna hematologická príprava pred invazívnymi výkonmi môže byť kontraproduktívna a ako racionálny sa môže javiť prístup „wait and see“. Odporúča sa tiež stratifikácia rizikových pacientov s cirhózou pečene (anamnéza krvácania, trombózy, stupeň invazivity výkonu) a manažovanie krvácavých prejavov počas invazívneho výkonu pomocou globálnych koagulačných testov (TEG).
Z hľadiska protrombotického stavu s klinickými následkami (okluzívne príhody, progresia fibrózy pečene) sa antitrombotická liečba javí ako prínosná, aktuálne je veľmi diskutovaná. Pacienti s cirhózou pečene by nemali byť vyraďovaní z preventívneho či liečebného použitia antitrombotických liekov. Pri ich indikácii a dávkovaní treba zohľadniť cestu ich metabolizmu, nález ezofageálnych varixov, prítomnosť renálnej insuficience a stupeň trombocytopénie.
Literatúra
- Lisman T, Porte Robert J, Rebalanced hemostasis in patients with liver disease: evidence and clinical Consequences, BLOOD, 12 AUGUST 2010, VOLUME 116, NUMBER 6
- Tripodi A, Mannucci PM, The Coagulopathy of Chronic Liver Disease, N Engl J Med, 2011, 365, 147 – 56
- Tripodi A , Anstee Q M, Sogaard KK, Primignani M, Valla D C, Hypercoagulability in cirrhosis: causes and consequences, J Thromb Haemost 2011, 9, 1713 – 1723
- Lisman T, Kamphuisen PW, Northup PG, Porte RJ, Established and new-generation antitrombotic drugs in patients with cirrhosis – Possibilities and caveats, Juornal of Hepatology, 2013, 59, 358 – 366
- Tripodi A, Mannucci PM, Abnormalities of hemostasis in chronic liver disease: Reappraisal of their clinical significance and need for clinical and laboratory research, Journal of Hepatology, 2007, 46, 727 – 733
- Lisman T, Caldwell SH, Burroughs AK, Northup PG, Senzolo M, Stravitz RT, Tripodi A, Trotter JF, Valla DC , Porte RJ, Coagulation in Liver Disease Study Group, Hemostasis and thrombosis in patients with liver disease: The ups and downs, Journal of Hepatology 2010 vol. 53 j 362 – 371
- Amitrano L, Guardascione MA, Management of Portal Vein Thrombosis in Cirrhotic Patients, Medit J Hemat Infect Dis 2009, 1(3)
- Kinjo N, Kawanaka H, Akahoshi T et all, Portal vein thrombosis in liver cirrhosis, World J Hepatol, 2014, 6(2), 64 – 71
- Hoekstra J, Janssen HLA, Vascular liver disorders (II ): portal vein thrombosis, The Netherlands J Med, 2009, 67, 2
- Sakalova A, Batorova A, Mistrík M, Hrubiško M a kol., Klinická hematológia, 2010, 178 – 179
- Fimognari FL, Violi F, Portal vein thrombosis in liver cirrhosis, Intern Emerg Med, 2008, 3, 213 – 218
- Ponziani FR, Zocco MA, Garcovich M et all, What we should know about portal vein thrombosis in cirrhotic patients: A changing perspective, World J Gastroenterol 2012 September 28; 18(36): 5014 – 5020
- Amitrano L, Brancaccio V, Guardascione MA et all, Inherited Coagulation Disorders in Cirrhotic Patients With Portal Vein Thrombosis, Hepatology, 2000, 31, 2, 345 – 348
- Caldwell S, Argo C, The Natural History of Non-Alcoholic Fatty Liver Disease, Dig Dis 2010; 28:162 – 168
- Charvát J, Hemokoagulace a játra, 2009
- Sogaard KK, Horváth-Puhó E et all, Risk of venous thromboembolism in patients with liver disease: a nationwide population-based case control study, Am J Gastroenterol 2009, 104, 96 – 101
- Kearon C, Akl EA, Comerota AJ et all, Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines, CHEST, 2012, 2, 478
- Valla DCh, The Coagulation System in End-Stage Liver Disease, 8th Paris Hepatitis Conference, 12.-13.January 2015
- Skladaný L, Šváč J, Molčan P, Čellárová E, Procedure-related bleeding in liver transplant candidates with and without preemptive haematological therapy based on classical haemocoagulation tests, 8th ELITA ELTR Meeting, Poster, LP003, Praha, 2014
- Villa E, Camma C, Marietta M et all, Enoxaparin prevents portal vein thrombosis and liver decompensation in patients with advanced cirrhosis. Gastroenetrolgy 2012, 143, 1253 – 1260








