Laboratórne diagnostické metódy využívané v diagnostike parazitárnych ochorení v posledných troch desaťročiach stagnovali. Pracovne náročné metódy ako napríklad mikroskopia predstavujú aj v dnešnej modernej dobe stále nosný pilier diagnostiky týchto ochorení. V posledných rokoch je však diagnostika parazitárnych ochorení založená najmä na novších diagnostických metódach – sérologických, molekulárnych a proteomických. Tento článok prináša prehľad laboratórnych metód používaných na diagnostiku parazitárnych ochorení u detí a u dospelých.
Úvod
Parazity predstavujú pôvodcov širokej skupiny rôznych ochorení (parazitózy), ktoré sú celosvetovo rozšírené. V minulosti bola drvivá väčšina týchto ochorení označovaná ako tropická, respektíve subtropická, nakoľko sa vyskytovali najmä v rozvojových krajinách, v krajinách s teplým podnebím a nízkym hygienickým štandardom. Celosvetová migrácia obyvateľstva však spôsobila, že sa niektoré – pôvodne tropické – ochorenia čoraz častejšie vyskytujú aj v iných krajinách. Existujú tri hlavné triedy parazitov, ktoré môžu spôsobiť ochorenia u ľudí: protozoá, helminty a článkonožce (1).

Výskyt parazitárnych nákaz je v Slovenskej republike pomerne nízky a zodpovedá európskemu štandardu. Vyššia incidencia bola zaznamenaná len u detí pochádzajúcich z rómskych rodín, v osadách a u bezdomovcov. Za rok 2020 boli hlásené: 2 prípady malárie, 74 prípadov toxoplazmózy, 3 prípady echinokokózy, 37 prípadov trichuriózy a 4 prípady toxokarózy. Nebol hlásený žiadny prípad ochorenia na schistosomózu, teniózu, trichinelózu, strongyloidózu a ostatné nešpecifikované protozoárne choroby a infekcie vyvolané plochými červami (cestódami) (2).
Mikroskopia
Zlatý štandard v diagnostike parazitárnych ochorení predstavuje aj v dnešnej modernej dobe mikroskopia. Popularita tejto techniky spočíva najmä v jej dostupnosti. Diagnostika pomocou mikroskopu si vyžaduje len samotný mikroskop, vzorku a v určitých prípadoch dostupné farbivá. Každá nová diagnostická metóda – molekulárna, sérologická alebo proteomická – väčšinou vyžaduje potvrdenie, respektíve porovnanie výsledku s mikroskopickým nálezom.

V prípade krvou prenosných protozoárnych infekcií je metódou voľby diagnostika pomocou mikroskopu (najmä mikroskopia krvných náterov zafarbených podľa Giemsa). Medzi bežné krvou prenosné protozoárne infekcie diagnostikované mikroskopickým vyšetrením patrí malária, babezióza, africká trypanozomóza, Chagasova choroba a leishmanióza. Malária patrí pre jej vysokú úmrtnosť k najvýznamnejším parazitárnym ochoreniam na svete. Rýchla diagnostika je nevyhnutná pre určenie vhodnej liečby, rovnako aj pre zabránenie ďalšiemu prenosu. Mikroskopické výsledky sú však závislé od špecialistu, ktorý vyšetrenie realizuje, čo spôsobuje, že citlivosť metódy sa mení (hlavná nevýhoda) (3).
Priama detekcia parazitov rodu Leischmania sa vykonáva mikroskopickým vyšetrením aspirátov zo sleziny, kostnej drene alebo lymfatických uzlín. Trypanosoma brucei je pôvodcom africkej trypanozomózy. Počas prvého štádia ochorenia možno nájsť parazity v periférnej krvi. Druhé štádium je typické tým, že parazity prechádzajú hematoencefalickou bariérou a infikujú centrálny nervový systém. Definitívna diagnóza sa stanovuje mikroskopickým vyšetrením krvi, aspirátu lymfatických uzlín alebo mozgovomiechového moku na prítomnosť parazitov (5).
Na diagnostiku amebiázy však mikroskopické vyšetrenie nie je vhodnou metódou, pretože Entamoeba histolytica, ktorá spôsobuje amébovú dyzentériu, je morfologicky identická s Entamoeba dispar, ktorá nespôsobuje žiadne ochorenie. Tieto dva druhy teda nemožno mikroskopicky rozlíšiť (6).
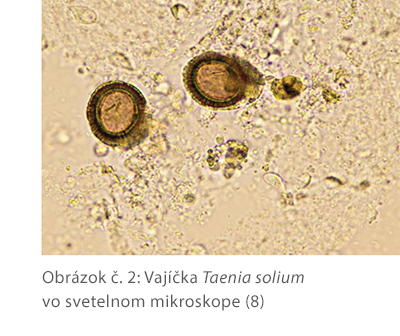
Priame pozorovanie helmintov pomocou mikroskopu najčastejšie spočíva v identifikácii vajíčok parazitov vo vyšetrovanej vzorke. V prípade črevnej schistosomiázy (Schistosoma mansoni a Schistosoma japonicum) sa diagnóza stanovuje pozorovaním vajíčok vo vzorkách stolice. V prípade močovej schistosomiázy (Schistosoma haematobium) sa infekcia diagnostikuje mikroskopickou detekciou vajíčok parazitov v moči pacienta. Diagnostika infekcie Taenia solium sa rovnako diagnostikuje pomocou nálezu vajíčok v stolici. Najvhodnejšie je vyšetrenie stolice odobratej počas 3 dní, aby sa zohľadnilo prerušované vylučovanie vajíčok parazita. Lymfatická filariáza, spôsobená hlístovými červami Wuchereria bancrofti a Brugia malayi, spôsobuje upchatie lymfatických ciev, čo vedie k nadmernému opuchu dolných končatín. Zlatým štandardom v diagnostike je mikroskopická identifikácia mikrofilárie v krvnom nátere. Najlepšie je realizovať odber krvi v noci, v dôsledku nočnej periodicity mikrofilárie (7).

Sérológické metódy
Vývoj nových mikrobiologických techník rozšíril možnosti diagnostiky aj v oblasti parazitológie. Sérológické vyšetrovacie metódy sú používané najmä v prípadoch, keď sú biologické vzorky alebo vzorky tkaniva nedostupné. Diagnostické nástroje založené na sérológii možno rozdeliť do dvoch kategórií: testy na detekciu antigénu a testy na detekciu protilátok – napr. ELISA, FAST-ELISA, Dot-ELISA, prípadne hemaglutinačný HA test, nepriamy alebo priamy imunofluorescenčný test (IFA alebo DFA), test fixácie komplementu a rýchle diagnostické testy. Sérologické testy sú citlivejšie a špecifickejšie v porovnaní s mikroskopiou. Stávajú sa dôležitými najmä pre pacientov, u ktorých krvné nátery neumožňujú identifikáciu parazita (napr. rozlišovanie medzi rodmi Babesia a Plasmodium) alebo u pacientov s nízkou parazitémiou (9).
Falconov skríningový test ELISA (FAST-ELISA) – podstatou je použitie syntetických a rekombinantných peptidov s následným vyhodnotením protilátkovej odpovede na prítomnosť antigénu. V minulosti sa metóda používala na diagnostiku malárie, fasciolózy, schistosomiázy a taeniázy. Nevýhodou je možnosť skríženej reakcie s bielkovinami iných druhov parazitov (10).

Dot-ELISA – hlavným rozdielom medzi klasickým ELISA testom a Dot-ELISA je nahradenie plastovej doštičky nitrocelulózovou alebo inou papierovou membránou, na ktorú sa aplikuje malé množstvo vzorky. Výber vhodnej väzbovej matrice výrazne zlepšil špecificitu a senzitivitu testu (znížením väzby nešpecifických proteínov). Výhodou metódy je rýchlosť, efektivita a možnosť použitia v teréne. Práve pre uvedené dôvody bola – a stále je – metóda Dot-ELISA vo veľkej miere používaná na diagnostiku parazitárnych chorôb ľudí a zvierat vrátane amébiázy, babeziózy, fasciolózy, kožnej a viscerálnej leishmaniózy, cysticerkózy, echinokokózy, malárie, schistosomiázy, toxokarózy, toxoplazmózy, trichinelózy a trypanozomózy (11).
Rýchle antigén-detekčné testy sú založené na imunochromatografickej detekcii antigénu a často sa využívajú ako doplnková diagnostická metóda k mikroskopii na diagnostiku malárie. Podstatou je zachytenie antigénu z kvapky krvi a jeho následná reakcia s protilátkami uloženými na nitrocelulózovom pásiku. Vzniknutý komplex antigén-protilátka je možné vizualizovať priamo z membrány (po pridaní pufra obsahujúceho značenú protilátku). Výhodou testov je ich rýchlosť, stabilita a jednoduchosť použitia. Používajú sa najmä na rýchlu diagnostiku malárie vyvolanej P. falciparum a P. vivax, avšak nie je možné ich použiť v prípadoch infekcií vyvolaných P. malariae a P. ovale (12).

Molekulárne metódy
Limity a obmedzenia mikroskopie a sérologických vyšetrovacích metód viedli v parazitológii k čoraz častejšiemu používaniu metód génovej amplifikácie – najmä polymerázovej reťazovej reakcie (PCR).
PCR, respektíve RT-PCR sa často používa na diagnostiku malárie, najmä u pacientov s nízkou parazitémiou. Použitím multiplexnej RT-PCR je možné identifikovať všetky štyri ľudské plazmódiá (Plasmodium falciparum, vivax, malariae a ovale) v jednej reakčnej skúmavke. Metóda je v praxi využiteľná aj na diagnostiku parazitárneho ochorenia vyvolaného Trypanosoma cruzi – Chagasova choroba (14).
Izotermálna amplifikácia sprostredkovaná slučkou (LAMP) je jedinečná amplifikačná metóda s mimoriadne vysokou špecifickosťou a citlivosťou. Vyznačuje sa použitím šiestich rôznych primerov, ktoré sú špecificky navrhnuté tak, aby rozpoznali osem rôznych oblastí na cieľovom géne, pričom k amplifikácii dochádza len vtedy, ak sa všetky primery naviažu. Metóda LAMP sa v parazitológii využíva na detekciu viacerých parazitov vrátane ľudských (napríklad Entamoeba spp., Trypanosoma spp., Taenia spp., Plasmodium spp., Babesia spp. a Cryptosporidium spp.) a dokonca aj na identifikáciu vektorových komárov prenášajúcich maláriu (15).

Technológia Luminex – guľôčkový prietokový cytometrický test umožňuje detekciu rôznych cieľových molekúl súčasne. Mikroguľôčky sa v priebehu reakcie kovalentne viažu na antigény, protilátky alebo na oligonukleotidy, ktoré slúžia v teste ako sondy. Testom Luminex je možné identifikovať viacero organizmov alebo rôzne genotypy jedného konkrétneho organizmu. Túto metódu je možné použiť najmä na diagnostiku parazitárnych ochorení vyvolaných rodmi Cryptosporidium spp. a Giardia spp. (16)
Proteomické metódy majú v súčasnosti dôležité miesto v diagnostike parazitárnych ochorení. Tieto nové techniky dokážu identifikovať biomarkery, ktoré kategorizujú vnímavých jedincov, rozlišujú medzi rôznymi štádiami infekcie a sledujú efekt antiparazitárnej liečby. Príkladom techniky, ktorá môže byť použitá na analýzu proteínovej expresie, je matricou asistovaná laserová desorpcia a ionizácia s analyzátorom doby letu (MALDI-TOF MS) (17).

Záver
Diagnostika parazitárnych infekcií je v súčasnosti postavená na troch základných pilieroch. Zlatým štandardom v diagnostike je priamy dôkaz pôvodcu ochorenia pomocou mikroskopie, ďalej detekcia antigénu, eventuálne protilátok pomocou sérologických vyšetrení a diagnostika pomocou molekulárnych metód založených najmä na nových laboratórnych postupoch využívajúcich metódy PCR, RT-PCR, Luminex, LAMP atď. Do popredia sa čoraz častejšie dostávajú aj moderné proteomické diagnostické metódy.
Literatúra
- Ricciardi A, Ndao M. Diagnosis of parasitic infections: what's going on? J Biomol Screen 2015;20:6e21
- Výročná správa o činnosti úradov verejného zdravotníctva v SR za rok 2020 - odborná časť (pdf)
- Mul drew, K. L. Molecular Diagnostics of Infectious Diseases. Curr. Opin. Pediatr. 2009, 21, 102 – 111
- Laboratory diagnosis of malaria infection – A short review of methods Kesinee Chotivanich1 Kamolrat Silamut2 Nicholas P J Day2,3 in the Australian Journal of Medical Science 2006; 27 (1): 11 – 15
- Wilburn, S. C., Maudlin, I. Priorities for the Elimination of Sleeping Sickness. Adv. Parasitol. 2012, 79, 299 – 337
- Gonin, P., Trudel, L. Detection and Differentiation of Entamoeba histolytica and Entamoeba dispar Isolates in Clinical Samples by PCR and Enzyme-Linked Immunosorbent Assay. J. Clin. Microbiol. 2003, 41, 237 – 241
- Guideline: Alternative mass drug administration regimens to eliminate lymphatic filariasis (WHO/HTM/NTD/PCT/2017.07). Geneva: World Health Organization; 2017
- Pernick N. Taenia species. PathologyOutlines.com website. https://www.pathologyoutlines.com/topic/parasitologytaeniaspecies.html. Accessed January 17th, 2022
- W. J. Carter, Z. Yan, N. D. Cassai, and G. S. Sidhu, “Detection of extracellular forms of babesia in the blood by electron microscopy: a diagnostic method for differentiation from Plasmodium falciparum,” Ultrastructural Pathology, vol. 27, no. 4, pp. 211 – 216, 2003
- N. Kumar, S. Ghosh, and S. C. Gupta, “Early detection of Fasciola gigantica infection in buffaloes by enzyme-linked immunosorbent assay and dot enzyme-linked immunosorbent assay,” Parasitology Research, vol. 103, no. 1, pp. 141 – 150, 2008
- Lodh, N.; Naples, J. M.; Bosompem, K. M.; et al. Detection of Parasite-Specific DNA in Urine Sediment Obtained by Filtration Differentiates between Single and Mixed Infections of Schistosoma mansoni and S. haematobium from Endemic Areas in Ghana. PLoS One. 2014, 9, e91144
- C. K. Murray, R. A. Gasser Jr., A. J. Magill, and R. S. Miller, “Update on rapid diagnostic testing for malaria,” Clinical Microbiology Reviews, vol. 21, no. 1, pp. 97 – 110, 2008
- Clinical practice The diagnosis of imported malaria in children Jessica Maltha & Jan Jacobs in Eur J Pediatr (2011) 170:821 – 829
- M. Diez, L. Favaloro, A. Bertolotti, et al., “Usefulness of PCR strategies for early diagnosis of Chagas’ disease reactivation and treatment follow-up in heart transplantation,” American Journal of Transplantation, vol. 7, no. 6, pp. 1633 – 1640, 2007
- S. Bretagne and J.-M. Costa, “Towards a nucleic acid-based diagnosis in clinical parasitology and mycology,” Clinica Chimica Acta, vol. 363, no. 1-2, pp. 221 – 228, 2006
- D. T. McNamara, L. J. Kasehagen, B. T. Grimberg, J. ColeTobian, W. E. Collins, and P. A. Zimmerman, “Diagnosing infection levels of four human malaria parasite species by a polymerase chain reaction/ligase detection reaction fluorescent microsphere-based assay,” The American Journal of Tropical Medicine and Hygiene, vol. 74, no. 3, pp. 413 – 421, 2006
- Ndao, M.; Spithill, T. W.; Caffrey, R.; et al. Identification of Novel Diagnostic Serum Biomarkers for Chagas’ Disease in Asymptomatic Subjects by Mass Spectrometric Profiling. J. Clin. Microbiol. 2010, 48, 1139 – 1149