Sekundárne dyslipoproteinémie (DLP) sú dôsledkom iného základného ochorenia, niektorých liekov, hormónov alebo špecifických vplyvov vonkajšieho prostredia ovplyvňujúcich metabolizmus lipidov a lipoproteínov po kvantitatívnej i kvalitatívnej stránke. Hlavné príčiny sekundárnych DLP sú nasledovné: endokrinné a metabolické ochorenia, chronické ochorenia obličiek, ochorenia pečene, nutričné a toxonutričné vplyvy, liekmi a hormónmi indukované DLP, hyperurikémia, akútne a chronické infekčné ochorenia, vzácne ochorenia, ako aj rôzne vonkajšie faktory. V určení sekundárnych DLP zohráva dôležitú úlohu laboratórna diagnostika.
Úvod
Poruchy metabolizmu plazmatických lipidov a lipoproteínov sú jednými z najdôležitejších rizikových faktorov pre rozvoj komplikácií aterosklerózy (infarkt myokardu, náhla cievna mozgová príhoda, aterosklerotické postihnutie ciev dolných končatín), ako aj pre rozvoj akútnej pankreatitídy.
Skríning lipidového profilu je odporúčaný u dospelých mužov nad 40 rokov, u žien nad 50 rokov alebo u menopauzálnych žien (úroveň EBM: trieda I, stupeň C), avšak pri prítomnosti ochorení uvedených v Tabuľke č. 1 vykonávame laboratórne vyšetrenie bez ohľadu na vek. Zásady laboratórnej diagnostiky a vzorce na výpočet indexov sú uvedené v Tabuľke č. 2.


U každého pacienta s abnormálnymi hodnotami lipidového spektra (celkový cholesterol, LDL cholesterol, HDL cholesterol, triacylglyceroly, Lp(a)) je našou prvoradou úlohou stanoviť, či ide o primárnu (genetickú, familiárne podmienenú) alebo sekundárnu (dôsledok iného základného ochorenia, niektorých liekov, hormónov alebo špecifických vplyvov vonkajšieho prostredia) dyslipoproteinémiu.
Suspekcia na primárnu DLP vzniká u pacientov s predčasnou ischemickou chorobou srdca (osobná a rodinná anamnéza) alebo u pacientov s rekurentnou pankreatitídou.

Pravdepodobnosť prítomnosti sekundárnej príčiny DLP je veľmi vysoká pri novovzniknutých alebo progredujúcich lipidových abnormalitách bez rodinnej anamnézy, pri zhoršení lipidového profilu u pacientov so stabilizovanou lipidovou abnormalitou, pri refraktérnych lipidových abnormalitách alebo pri akútnej závažnej exacerbácii predchádzajúcej miernej DLP.
Sekundárne DLP vedú k rovnakým komplikáciám ako primárne DLP (akcelerácia aterosklerózy a akútna pankreatitída). Sekundárnu príčinu DLP musíme vylúčiť pred stanovením ďalšieho terapeutického postupu, pretože ochorenie vyvolávajúce sekundárnu DLP sme schopní kauzálne liečiť a tým dosiahnuť aj odstránenie sekundárnej DLP.
Treba však pamätať na to, že môže ísť o súčasný výskyt primárnej a sekundárnej (pri základnom ochorení) DLP, ako aj na to, že prítomnosť základného ochorenia môže manifestovať primárnu DLP (napr. hypotyreóza manifestujúca familiárnu dysbetalipoproteinémiu u homozygota apo E2/E2 – Tabuľka č. 3).
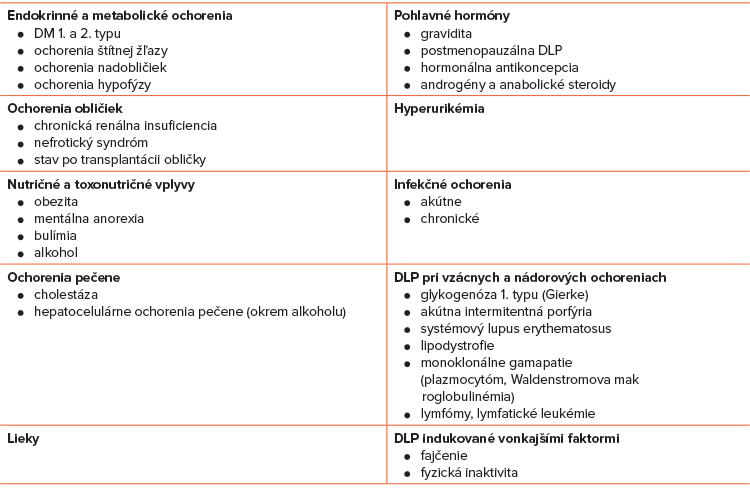
Hlavné príčiny sekundárnych DLP sú nasledovné: endokrinné a metabolické ochorenia, chronické ochorenia obličiek, ochorenia pečene, nutričné a toxonutričné vplyvy, liekmi a hormónmi indukované DLP, hyperurikémia, akútne a chronické infekčné ochorenia, vzácne ochorenia, vonkajšími faktormi indukované DLP (Tabuľka č. 4).
Treba mať na pamäti, že stanovenie lipidového spektra nám väčšinou neurčí, či ide o primárnu alebo sekundárnu DLP, a preto je potrebné nielen klinické, ale aj ďalšie podrobné laboratórne vyšetrenie.
Endokrinné a metabolické ochorenia
Poruchy metabolizmu plazmatických lipidov a lipoproteínov pri diabetes mellitus (DM) 1. a 2. typu majú rôznu patogenézu. Ich metabolizmus ovplyvňuje inzulín (aktiváciou lipoproteínovej lipázy (LPL) zabezpečuje odbúravanie častíc bohatých na triacylglyceroly (TAG) z plazmy, inhibíciou aktivity hormón-senzitívnej lipázy spomaľuje hydrolýzu TAG v adipocytoch, a tak znižuje množstvo cirkulujúcich voľných mastných kyselín (VMK), priamo inhibuje produkciu VLDL pečeňovou bunkou, čo má význam najmä v postprandiálnom období). Sekundárna DLP pri DM je indukovaná chronickou nedostatočnou kompenzáciou alebo akútnou dekompenzáciou základného ochorenia. V prípade, že DLP pretrváva pri dobrej kompenzácii DM, môže ísť o koincidenciu DM a primárnej DLP.
Pre DM 1. typu je charakteristický tesný vzťah medzi kompenzáciou a zmenami koncentrácie (najmä) TAG a celkového cholesterolu (TC). Väčšina dobre kompenzovaných diabetikov 1. typu má normálne lipidové spektrum. Absolútny nedostatok inzulínu vedie k zvýšenej lipolýze v tukovom tkanive, k zvýšenej produkcii VLDL v pečeni a spomalenému odbúravaniu VLDL a chylomikrónov z cirkulácie (zvýšenie TAG). Zvyšuje sa aj koncentrácia Lp(a). Pri rekompenzácii sa však sérové lipidy rýchlo normalizujú.

Dyslipidémiu (aterogénna DLP, lipidová triáda, aterogénny lipoproteínový fenotyp) pri DM 2. typu charakterizuje inzulínová rezistencia (IR) spojená s hyperinzulinémiou a obezitou (podobne ako u pacientov s metabolickým syndrómom – MS) (Tabuľka č. 5).
Zvýšená ponuka energetických substrátov indukuje v pečeni syntézu na TAG bohatých VLDL častíc, ktoré sú katabolizované na malé denzné (MD) LDL častice s vysokým aterogénnym potenciálom. Pre diabetickú DLP je typické zvýšenie TAG, zníženie HDL-C (kvantitatívne i kvalitatívne zmeny) a prítomnosť MD LDL a MD HDL častíc. TC a LDL-C sú často mierne zvýšené nad cieľové hodnoty. DLP reaguje na zmeny v kompenzácii diabetikov 2. typu pomalšie než u diabetikov 1. typu, pri dekompenzácii sa koncentrácie lipidov zvyšujú, ale k ich absolútnej normalizácii často nevedie ani veľmi dobrá kompenzácia. Aj zhoršenie diabetickej mikroalbuminúrie vedie k zvýšeniu koncentrácie TAG, pri zachovaní dobrej kompenzácie DM.
Z laboratórnych vyšetrení využívame napríklad stanovenie lipidového spektra. Niektoré laboratóriá sú schopné stanoviť LDL-C priamo, bez použitia výpočtu Friedewaldovou rovnicou, a takisto dokážu stanoviť koncentráciu MD LDL. U diabetikov je dôležité vyšetrenie glykemickej triády (glykémia nalačno, postprandiálne, glykovaný hemoglobín) a mikroalbuminúrie.

Vzhľadom na vysoký kardiovaskulárny (KV) rizikový potenciál prediabetikov a diabetikov musíme týchto pacientov aktívne vyhľadávať. V ambulanciách praktických lekárov by mal mať každý pacient s DLP vyšetrenú glykémiu nalačno. V prípade, že je glykémia v rozmedzí > 5,6 mmol/l a < 6,99 mmol/l, musíme vykonať orálny glukózový tolerančný test (oGTT) so 75 g glukózy rozpustenej vo vode. Vzorky na stanovenie glykémie sa odoberajú nalačno a po dvoch hodinách. oGTT môže viesť k stanoveniu prediabetických štádií – hyperglykémie nalačno (glykémia nalačno > 5,6 mmol/l a < 6,99 mmol/l, po 2 hodinách < 7,8 mmol/l) a poruchy tolerancie glukózy (glykémia nalačno > 5,6 mmol/l a < 6,99 mmol/l, po 2 hodinách > 7,8 mmol/l a < 11,1 mmol/l). Pacienti v obidvoch skupinách majú vysoké riziko progresie do DM 2. typu. Diagnóza DM je potvrdená, ak glykémia nalačno > 7,0 mmol/l a po 2 hodinách > 11,1 mmol/l (Tabuľka č. 6).
Hypotyreóza vedie k najčastejšie citovanej sekundárnej DLP (porucha metabolizmu lipoproteínov je citlivým indikátorom biologického účinku hormónov štítnej žľazy). Pre hypotyreózu je charakteristické zvýšenie TC a LDL-C (znížená koncentrácia trijódtyronínu (T3) ovplyvňuje expresiu LDL receptorov na pečeňovej bunke), ľahké zvýšenie TAG (redukcia katabolizmu TAG a zníženie aktivity LPL) a mierne zvýšenie HDL-C (znížený transfer esterov cholesterolu do ostatných lipoproteínov) (Tabuľka č. 7). U pacientov s TC > 8 mmol/l býva až v 4 % prítomná hypotyreóza (subklinická hypotyreóza až v 8 %), častejšie u žien než u mužov. Pri diferenciálnej diagnostike DLP nesmie chýbať laboratórne vyšetrenie TSH, prípadne fT4. TSH musíme vyšetriť aj u pacientov so zhoršeným lipidovým profilom, ktorí boli doposiaľ dobre kontrolovaní na diéte a hypolipidemickej liečbe. Hypotyreóza, ale aj DM 2. typu alebo obezita môžu byť spúšťačom, ktorý zapríčiní expresiu primárnej DLP – familiárnej dysbetalipoproteinémie (HLP typu III podľa Fredricksonovej klasifikácie) charakterizovanej genotypom apo E2,/E2.
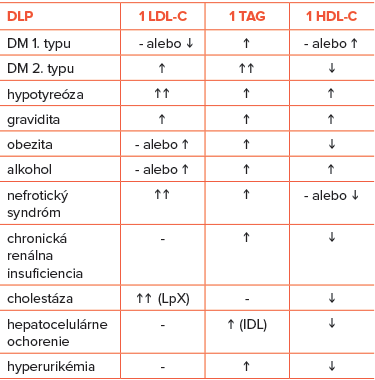
Hypertyreóza je vo svetovej literatúre charakterizovaná prítomnosťou znížených hladín LDL-C a HDL-C s pretrvávaním hypertriacylglycerolémie (hyperTAG). Avšak u slovenských pacientov s hypertyreózou nachádzame – v dôsledku vyššieho príjmu cholesterolu potravou – vyššie hladiny TC a LDL-C (Tabuľka č. 7).
Pri zvýšenej sekrécii glukokortikoidov (Cushingov syndróm) dochádza k vzostupu TC i TAG. Príčinou je zvýšenie lipolýzy v tukovom tkanive, zvýšený obrat voľných mastných kyselín (VMK), porucha citlivosti tkanív na inzulín a zvýšená sekrécia VLDL v pečeni. Liečba DLP nie je indikovaná, najprv treba liečiť základné ochorenie. Laboratórne vyšetrenie základného ochorenia je zamerané na stanovenie koncentrácie ACTH (adrenokortikotropný hormón), kortizolu (strata cirkadiánneho plazmatického rytmu) a exkrécie kortizolu v moči. Podrobnejšia diagnostika patrí do rúk endokrinológa.
Zvýšená sekrécia katecholamínov (stres, trauma, feochromocytóm) pôsobí antagonisticky voči inzulínu, vedie aj k aktivácii lipolýzy s následnou kumuláciou lipidov v pečeni, vo svalovom tkanive a v myokarde. Pri rutinnom laboratórnom vyšetrení zistíme hyperTAG.
Nedostatok rastového hormónu (STH) zvyšuje koncentráciu TC, LDL-C, TAG, apo B a znižuje koncentrácie HDL-C. Deficit rastového hormónu v dospelosti často uniká pozornosti a často býva príčinou pretrvávajúcej DLP.
Pacienti s akromegáliou a s intaktnou funkciou hypofýzy majú nižšie hodnoty TC a zvýšené TAG v porovnaní s ostatnou populáciou (výskyt endogénnej hyperTAG je trojnásobne vyšší). Príčina zvýšenia TAG pri akromegálii nie je jasná.

Ochorenia obličiek
Počet pacientov s chronickým obličkovým ochorením sa neustále zvyšuje. Vyššie riziko vzniku KV ochorení a zvýšená prevalencia KV morbidity aj mortality je evidentná vo všetkých vekových skupinách. Paradoxne sa u väčšiny pacientov s chronickým obličkovým ochorením nerozvinie obličkové zlyhanie, pretože takmer 58 % z nich predčasne zomiera na KV príhody. Z tradičných rizikových faktorov aterosklerózy má kľúčovú úlohu DLP (veľmi častý nález) a to nielen v počiatočných štádiách, ale aj v pokročilých štádiách chronického obličkového ochorenia. Lipidový profil závisí nielen od štádia poškodenia obličiek, ale aj od stupňa proteinúrie (Tabuľka č. 8). Pacienti s nefrotickým syndrómom majú vyšší výskyt lipidových abnormalít než pacienti bez prítomnosti nefrotického syndrómu.
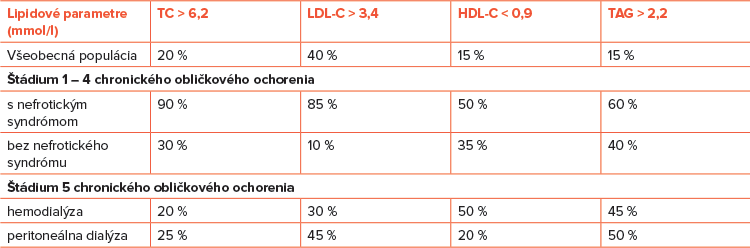
Pred rozvojom chronického obličkového ochorenia bývajú v lipidovom spektre najčastejšie zvýšené TC a LDL-C. Ako sa chronické obličkové ochorenie vyvíja do zlyhania obličiek, výskyt zvýšeného TC a LDL-C klesá. Aj napriek tomu, že pacienti zaradení do chronického dialyzačného programu (peritoneálna dialýza, hemodialýza) majú hladiny LDL-C nižšie ako vo všeobecnej populácii, takmer polovica z nich má LDL-C > 2,6 mmol/l a non HDL-cholesterol (non HDL-C) > 3,4 mmol/l. Súčasne v laboratórnom obraze nachádzame nízke hladiny HDL-C a vyššie hladiny TAG. U týchto pacientov sú prítomné kvantitatívne aj kvalitatívne abnormality lipidov a lipoproteínov (zvýšenie koncentrácií lipoproteínu a (Lp (a), prítomnosť aterogénnych oxidovaných LDL častíc). Pre neskoré štádiá chronického obličkového ochorenia je charakteristický lipidový profil s hyperTAG, nízkymi hodnotami HDL-C a relatívne normálnymi hladinami LDL-C (lipidový profil vyskytujúci sa u pacientov s prítomnou inzulínovou rezistenciou – diabetici 2. typu alebo pacienti s MS).
Po transplantácii obličky sa so zlepšením renálnych funkcií upravujú aj abnormality lipoproteínov (zvyšuje sa koncentrácia HDL-C, klesá koncentrácia TAG a Lp(a)). Asi u jednej štvrtiny pacientov však pretrváva DLP (typickým obrazom je hypercholesterolémia, menej častá býva kombinovaná DLP). Príčin vzniku hypercholesterolémie môže byť viac (zmena diéty – zvýšený príjem tukov a cholesterolu, nárast hmotnosti, glukokortikoidy, cyklosporín, nefrotický syndróm). HyperTAG môže byť dôsledkom zvýšeného kalorického príjmu s rozvojom obezity, terapie glukokortikoidmi alebo vzniku sekundárneho DM.
Ochorenia pečene
Pečeň (spolu s tenkým črevom) hrá dominantnú úlohu pri syntéze lipidov a apolipoproteínov, ako aj pri vychytávaní lipoproteínov z cirkulácie, je zdrojom kľúčových enzýmov a receptorov ovplyvňujúcich metabolizmus plazmatických lipoproteínov.
Cholestázu definujeme ako stagnáciu žlče v intrahepatálnych (primárna biliárna cirhóza a sklerotizujúca cholangoitída) a extrahepatálnych žlčových cestách (cholecystolitiáza, karcinóm pankreasu, karcinóm žlčových ciest) s následnou retenciou žlčových substancií v krvi. Cholestáza vedie k vzostupu cholesterolu v dôsledku zvýšenia koncentrácie voľného cholesterolu v atypickom lipoproteíne X. Pri primárnej biliárnej cirhóze sú koncentrácie TC 10 – 15 mmol/l (príčinou rozvoja hypercholesterolémie je blok exkrécie cholesterolu, regurgitácia žlčového cholesterolu, zvýšená syntéza cholesterolu a spomalené vychytávanie cholesterolu z krvi), TAG bývajú väčšinou normálne – ak sú zvýšené, bývajú transportované v atypických časticiach označovaných ako lipoproteín Y. V klinickom obraze bývajú prítomné aj rozsiahle xantelazmy viečok. Sekvestranty žlčových kyselín síce odstránia nepríjemné svrbenie, ale ich efekt na koncentráciu TC je minimálny. Fibráty a statíny sú kontraindikované vzhľadom na potenciálnu hepatotoxicitu.
Hepatocelulárne ochorenia pečene: pri akútnych hepatitídach nachádzame zvýšené koncentrácie TAG a znížené hodnoty TC. Pri chronických ochoreniach pečene nemusíme zachytiť výraznejšie zmeny krvných lipidov a lipoproteínov, zatiaľ čo pri cirhóze pečene bývajú hodnoty TC a TAG normálne alebo znížené. Nealkoholová steatóza pečene (NAFL) je často združená s hyperTAG (avšak vždy je nutné prvotne vylúčiť konzumáciu alkoholu).
Pri nutnosti farmakoterapie DLP (sekundárna prevencia ICHS) pri hepatocelulárnych ochoreniach pečene musíme postupovať opatrne (pravidelná kontrola pečeňových enzýmov, redukcia dávky hypolipidemika, zvažovanie prínosu liečby voči riziku zhoršenia hepatálnych funkcií a prognózy chorého).
Nutričné a toxonutričné vplyvy

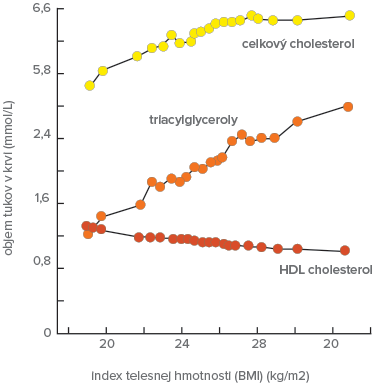
V ostatných desaťročiach došlo k alarmujúcemu zvýšeniu nadhmotnosti a obezity v mnohých krajinách sveta. U obéznych pacientov sa najčastejšie stretávame s prítomnosťou už vyššie spomínanej aterogénnej dyslipidémie. BMI koreluje s koncentráciou TC a LDL-C (u mladých obéznych osôb), s koncentráciou TAG koreluje vo všetkých vekových skupinách. Redukcia hmotnosti o 1 kg vedie v priemere k poklesu TC i LDL-C o 1 % a TAG o 2 – 3 %. HDL-C spočiatku klesá, po stabilizácii hmotnosti sa zvyšuje od 2 – 3 % na kg redukovanej hmotnosti.
Mentálna anorexia je ochorenie najmä mladých žien vo veku 13 až 26 rokov (prevalencia v tomto veku je 0,5 – 1 %). Klinické črty mentálnej anorexie sú ľahko rozpoznateľné (strata hmotnosti vyplývajúca z chybnej percepcie hmotnosti). Termín anorexia znamená stratu apetítu, pri mentálnej anorexii je však apetít potláčaný rôznymi aberantnými behaviorálnymi vplyvmi. Hladovanie a chronická podvýživa sú obyčajne sprevádzané nízkymi hodnotami TC. Pri mentálnej anorexii je prítomná hypercholesterolémia. Mechanizmus týchto zmien nie je presne známy (redukcia vychytávania a degradácie LDL častíc, početné hormonálne abnormality – redukcia T3 a estrogénov, hypersekrécia kortikosteroidov). S normalizáciou hmotnosti sa normalizujú aj sérové lipidy.
Bulímia nervosa je syndróm charakterizovný relatívne krátkymi epizódami masívneho prejedania sa, vyskytujúci sa najmä v kaukazskej populácii (až 90 % pacientov sú ženy, postihuje 1 – 3 % adolescentných dievčat a žien). Údajov o vplyve bulímie na krvné lipidy je málo, väčšinou však nemá vplyv na lipidové spektrum.
Vplyv konzumácie alkoholu na krvné lipidy a mortalitu je kontroverzný. Alkohol v nízkych dávkach zvyšuje HDL-C (nezávisle od druhu alkoholu), znižuje riziko trombogenézy, čo je pravdepodobne vysvetlením jeho protektívneho účinku na KV mortalitu. Vo vyšších dávkach (u disponovaných osôb aj v nižších dávkach) indukuje sekundárnu DLP. Vyššia konzumácia alkoholu má rôzne zdravotné (hypertenzia, pečeňové ochorenia, hemoragické NCMP) a sociálne riziká. Alkoholová DLP môže byť prítomná v nasledujúcich klinických formách.
1. DLP asociovaná s pravidelnou miernou konzumáciou alkoholu. Mierna konzumácia alkoholu vedie k zvýšeniu HDL-C u oboch pohlaví, pričom sa zvyšuje hladina najmä menších a denznejších HDL3 častíc. Mierna konzumácia alkoholu ovplyvňuje aj apolipoproteíny (apo A-I a apo A-II), pričom výraznejší efekt je na apo A-II. Pri miernej konzumácii alkoholu veľmi zriedka dochádza k hyperTAG.
2. DLP inej etiológie zhoršená konzumáciou alkoholu. Aj malé dávky alkoholu môžu demaskovať subklinickú primárne podmienenú DLP. Konzumácia alkoholu najčastejšie znižuje schopnosť odstraňovania krvných lipoproteínov (primárne alebo sekundárne – napr. u diabetikov – znížená aktivita LPL) a zvyšuje produkciu (primárne alebo sekundárne – sacharidmi indukovaná) VLDL v pečeni. U obéznych osôb je tento účinok výraznejší. Indikátorom úlohy alkoholu pri vzniku DLP je promptné zníženie TAG (o 25 %) v priebehu 10-dňovej abstinencie.
3. Akútna DLP po alkoholovom excese sa prejaví zvýšením všetkých lipoproteínových frakcií (VLDL, chylomikrónov a chylomikrónových remnantných častíc). Laboratórnym vyšetrením zistíme niekoľkonásobný vzostup koncentrácie TAG v chylóznom sére. Pokiaľ excesu predchádzala chronická konzumácia alkoholu, môže vzniknúť ťažká kombinovaná DLP s následným vznikom akútnej pankreatitídy.
4. Typickou DLP pri chronickom alkoholizme je hyperTAG alebo kombinovaná DLP. HyperTAG je častá u pacientov so steatózou pečene a s miernym zvýšením aminotransferáz. Zriedkavá je u pacientov s cirhózou pečene. U pacientov s hyperTAG sa zvyšuje GMT nezávisle od konzumácie alkoholu (nepomôže nám pri identifikácii chronického alkoholizmu). Odlíšenie DLP spôsobenej chronickou konzumáciou alkoholu od DLP indukovanej hepatocelulárnym ochorením pečene býva niekedy prakticky nemožné.
5. DLP asociovaná s alkoholovým poškodením pečene. S progresiou alkoholového poškodenia pečene (cirhóza pečene, zlyhávanie pečene) dochádza k úprave TAG (znižuje sa sekrécia VLDL) a prehlbuje sa deficit pečeňou produkovaných faktorov zasahujúcich do regulácie lipoproteínov.
Vplyv hormónov a liekov na DLP
Sekundárna alterácia sérových lipidov a lipoproteínov sa môže vyskytnúť pri podávaní mnohých liekov aplikovaných na liečbu iných základných ochorení.
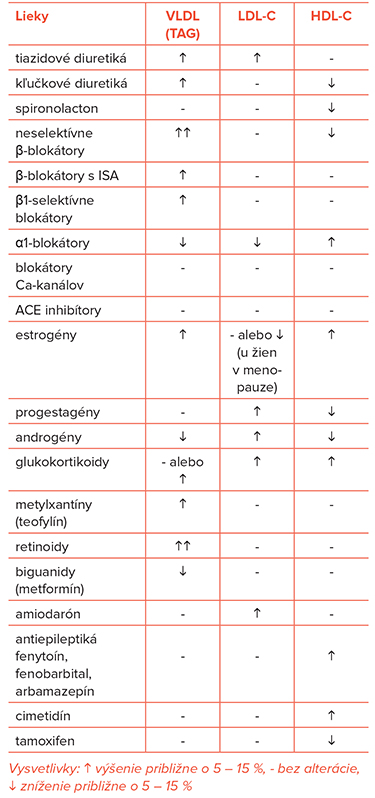
Estrogény vo fyziologických dávkach zvyšujú HDL-C a znižujú LDL-C, vo vyšších dávkach zvyšujú TAG. Gestagény môžu zvyšovať LDL-C a znižovať HDL-C. Moderná hormonálna antikoncepcia s nižšími dávkami hormónov – na rozdiel od starších typov s vyššou dávkou hormónov – lipidové spektrum významnejšie neovplyvňuje.
Zvýšená koncentrácia estrogénov počas gravidity spôsobuje fyziologickú DLP (zvýšenie LDL-C o 25 %, zvýšenie TAG i HDL-C) s návratom k normálnym hodnotám po pôrode (kontrolu lipidov uskutočníme najskôr o 6 mesiacov po pôrode).
Menopauza má taktiež vplyv na lipidové spektrum – počas prvých dvoch rokov sa kontinuálne zvyšuje koncentrácia TC a LDL-C (aj prítomnosť MD LDL častíc), ako aj TAG, pričom klesá HDL-C.
Androgény a anabolické steroidy zvyšujú – v závislosti od dávky a dĺžky podávania – LDL-C (o 36 %) a znižujú HDL-C (o 50 %).
Glukokortikoidy vedú k vzostupu koncentrácie LDL-C a TAG, pri pulznom podávaní vysokých dávok môže vzniknúť ťažká sekundárna DLP. Chronická liečba glukokortikoidmi a cyklosporínom vedie k miernej kombinovanej DLP.
Tiazidové a kľučkové diuretiká mierne zvyšujú koncetráciu TAG a LDL-C. Neselektívne β-blokátory s ISA môžu v závislosti od dávky zvyšovať TAG a znižovať HDL-C, ako aj zhoršovať glukózovú toleranciu. α-1-blokátory môžu, naopak, znižovať LDL-C a TAG a zvyšovať HDL-C.
Hyperurikémia a DNA
Býva prítomná u viac než 50 % mužov s hyperTAG (veľmi často zhoršovaná súčasným podávaním tiazidových diuretík). Hypeurikémia a hyperTAG pritom nie sú v kauzálnom vzťahu a príčina tejto asociácie nie je jasná. Možným vysvetlením by mohla byť koincidencia faktorov ako obezita alebo chronická konzumácia alkoholu. Lieky znižujúce kyselinu močovú (allopurinol) neovplyvňujú koncentráciu TAG a lieky ovplyvňujúce metabolizmus lipidov nemajú vplyv na kyselinu močovú, avšak okrem dvoch výnimiek – kyselina nikotínová zvyšuje koncentráciu kyseliny močovej v sére a fenofibrát ju znižuje prostredníctvom nezávislého urikozurického efektu.
Infekčné ochorenia
Protozoálne, vírusové a bakteriálne infekcie môžu vplyvom aktivácie stresových hormónov a cytokínov viesť k hyperTAG. Infekcie vyvolané G- mikroorganizmami môžu viesť k výraznejšiemu zvýšeniu TAG, ako aj TC. Pri infekciách spôsobených G+ baktériami sa TC nezvyšuje, niekedy dokonca klesá. Pri vírusových infekciách (chrípka) sa zvyšujú TAG a klesá LDL-C (pravdepodobne ako dôsledok nechutenstva pri horúčkovitom ochorení). Chronické infekčné ochorenia vedú spravidla k zvýšeniu TAG a poklesu LDL-C. Výsledky vyšetrenia lipidov počas akútneho ochorenia sú vždy zmenené, nepoužívame ich pri rozhodovaní o KV riziku a liečbe DLP (vyšetrenie vykonáme o mesiac pri ľahšom infekčnom ochorení, pri ťažšom ochorení ho vykonáme až o tri mesiace).
DLP pri vzácnych ochoreniach
Glykogenóza 1. typu (Gierke) je autozomálne recesívne ochorenie s deficitom glukózo-6-fosfatázy (v klinickom obraze býva prítomná hypoglykémia, laktacidémia, DLP s eruptívnymi kožnými xantómami a steatózou pečene). V laboratórnom obraze býva závažná kombinovaná DLP (výrazné zvýšenie TAG, mierne zvýšenie TC v chylóznom sére).
Akútna intermitentná porfýria býva sprevádzaná zvýšenými hodnotami LDL-C a HDL-C. Etiológia tejto alterácie nie je známa, býva skôr spojená s akútnym atakom porfýrie, nebýva prítomná v remisii.
Abnormality lipidového spektra nie sú typickou črtou systémového lupus erytematosus, okrem pacientov s komplikáciami (gastroenteropatia so stratou proteínov), u ktorých býva prítomná hypercholesterolémia.
DLP indukovaná vonkajšími faktormi
Fajčenie je jedným z hlavných rizikových faktorov pre rozvoj aterosklerózy a jej kardio-cerebro-vaskulárnych komplikácií, ako aj periférneho arteriálneho ochorenia. Okrem zvýšenia tvorby voľných kyslíkových radikálov so zvýšením oxidácie LDL častíc a zníženia koncentrácie HDL-C má aj priamy cytotoxický efekt – zvyšuje produkciu cytokínov (zápalový proces v stene cievy) a podporuje vazospazmus.
Čaj a káva v bežných dávkach nemajú vplyv na krvné lipidy. Pri veľkej konzumácii kávy (viac než 700 ml denne) sa však zvyšuje koncentrácia TC (zalievaná káva je rizikovejšia než filtrovaná alebo prekvapkávaná).
Zloženie stravy – strava bohatá na jednoduché cukry indukuje hyperTAG, zvýšená konzumácia mäsa a mäsových výrobkov vedie k zvýšeniu LDL-C. Následkom zvýšenej konzumácie živočíšnych tukov dochádza k zvýšeniu TAG, ako aj LDL-C (vnímavosť je geneticky podmienená).
Fyzická inaktivita vedie k hyperTAG a k poklesu HDL-C.
Záver
Napriek tomu, že až 90 % DLP má charakter primárnych DLP, v našej klinickej praxi musíme myslieť aj na možnosť výskytu sekundárnej DLP. Laboratórna diagnostika sa opiera o stanovenie celého lipidového spektra (aspoň 2 odbery krvi) so zachovaním dostatočného odstupu (4 – 6 týždňov) od akéhokoľvek interkurentného ochorenia. Na vylúčenie sekundárnych DLP stanovujeme základné laboratórne parametre podľa klinickej úvahy o ochorení podmieňujúcom ich vznik. Laboratórne vyšetrenie je síce veľmi dôležité, ale treba si uvedomiť, že diagnostika DLP nemá vychádzať len z laboratórnych hodnôt. Súčasťou diagnostiky musí byť komplexné vyšetrenie so znalosťou rodinnej a osobnej anamnézy, fyzikálne vyšetrenie (hmotnosť, výška, BMI, obvod pása, krvný tlak) a pátranie po prítomnosti primárnych aj sekundárnych prejavov DLP. Diagnostikovanie sekundárnych DLP nám umožní následnú kauzálnu liečbu základného ochorenia. V prípade, že ani pri kauzálnej liečbe nedochádza k úprave lipidového spektra a pacient má vysoké KV riziko, môže byť aj pri sekundárnej DLP indikovaná hypolipidemická liečba. Výber hypolipidemika a začatie liečby sa riadia rovnakými pravidlami ako pri primárnych DLP.
Literatúra
- Ballantyne CM. Clinical Lipidology: a companion to Braunwald's heart disease. 2009; Elsevier: pp 584
- Catapano AL, Reiner Z, de Backer G et al. ESC/EAS Guidelines for the management of dyslipidaemias: The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Atherosclerosis 2011; 217:1 – 44.
- Češka R. a kol. Metabolizmus. Hyperlipoproteinémie a dyslipoproteinémie. In Interna (Eds Češka R, Tesař V, Dítě P, Štulc T) Triton, Praha 2010: 256 – 265.
- Fábryová Ľ. Dyslipoproteinémie. In. Všeobecná a klinická endokrinológia (Eds: Kreze A, Langer P, Klimeš I, Stárka L. Payer J, Michálek J.) Academic Electronic Press, Bratislava, 2004: 529 – 552.
- Fábryová Ľ. Algoritmus diagnostiky a liečby dyslipoproteinémií. Interná med. 2010; 10 (10): 495 – 505.
- Fábryová Ľ. Kardiometabolické riziká obezity. In Klinická obezitológia (Eds: Krahulec B, Fábryová Ľ, Holéczy P, Klimeš I) Facta Medica, Brno, 2013: 166 – 177.
- Fábryová Ľ. Kombinačná hypolipidemická liečba v súčasnej klinickej praxi. Via pract. 2014; 11(6): 201 – 206
- Filipová S, Fábryová Ľ, Mikeš Z, Tkáč I. za kolektív odborníkov. Aktualizácia lipidového konsenzu-2. Cardiol 2006; 15(6): 313 – 316.
- Chapman MJ, Ginsberg HN, Amarenco P et al. for the European Atherosclerosis Society Consensus Panel. Triglyceride-rich lipoproteins and high-density lipoprotein cholesterol in patients at high risk of cardiovascular disease: evidence and guidance for management. Eur Heart J 2011; 32: 1345 – 61.
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease.Kidney inter. Suppl. 2013; 3: 1 – 150.








