Melanóm je nádor, ktorý vznikol transformáciou melanocytu, bunky produkujúcej pigment. Napriek tomu, že tvorí iba 4 % kožných nádorov, spôsobuje 79 % úmrtí na nádory kože (1).
EPIDEMIOLÓGIA
Melanóm patrí k nádorom s výrazne stúpajúcim počtom. Incidencia v posledných 30 rokoch vzrastá každoročne o 3 %. V súčasnosti varíruje od 0,2/100 000 žien v Indii do 42/100 000 v Severnom Queenslande v Austrálii (2, 3). V mužskej populácii sa incidencia pohybuje od 0,5 do 49 na 100 000 obyvateľov. V Českej republike bola v roku 2002 incidencia u mužov 10,5/100 000 obyvateľov a u žien 9,6/100 000 obyvateľov (1). V dôsledku včasného záchytu melanómu stúpa mortalita významne pomalšie než incidencia (Obrázok č. 1). Súvisí to pravdepodobne so stúpajúcim záchytom melanómov vo včasných štádiách. Okrem už spomínaných geografických rozdielov ovplyvňujú epidemiológiu aj pohlavie, vek (vrcholy výskytu medzi 30. – 40. a 55. – 70. rokom) a rasové rozdiely (5).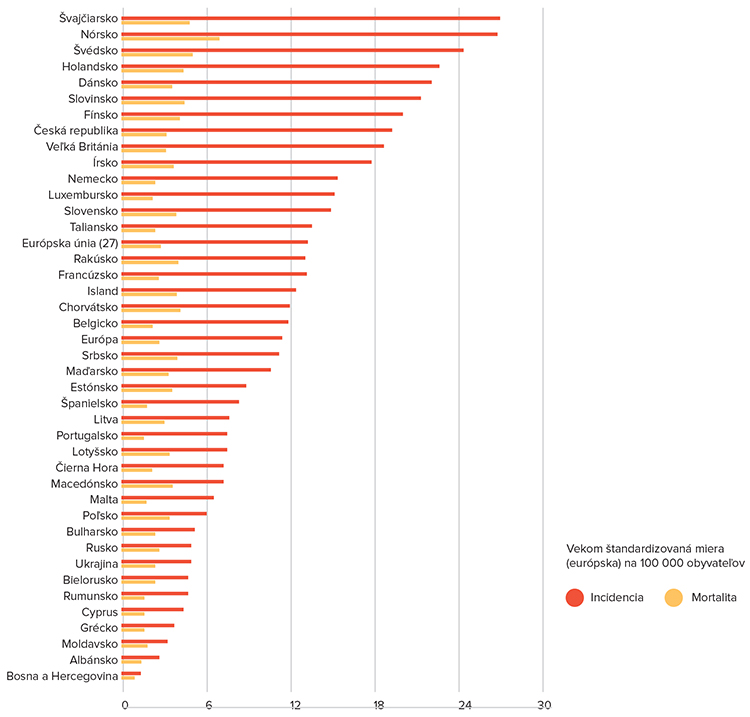
ETIOPATOGENÉZA
Transformáciu melanocytu na melanóm možno rozdeliť na niekoľko etáp. V prvej dochádza k aberantnému rastu a množeniu névocytov, ktoré vytvárajú hniezda s rôznym stupňom dysplázie. Ďalším stupňom je malígna transformácia buniek na atypické melanocyty. Nádor sa v tejto fáze šíri radiálne v epiderme a môže dosahovať k dermoepidermálnemu rozhraniu (tzv. radiálna rastová fáza). Postupne nádor invaduje do hĺbky dermy (vertikálna rastová fáza). Posledným štádiom je invázia nádorových buniek do lymfatických alebo krvných ciev (Obrázok č. 2) (6).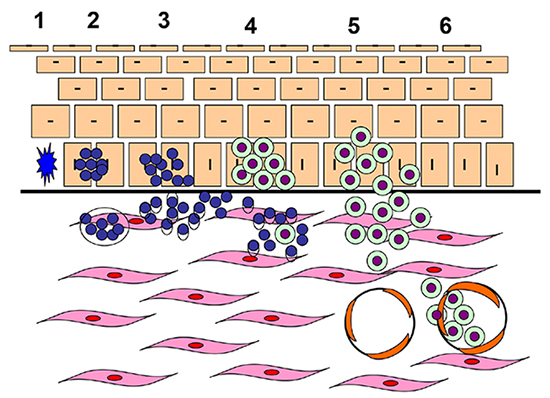
Vznik melanómu je dôsledkom environmentálne indukovaného narušenia bunkových genetických kontrolných mechanizmov. Chromozómové aberácie na chromozómoch 1, 6, 7, 9, 10 a 11 sa opisujú pri sporadických aj familiárnych melanómoch. Geneticky podmienený je fototyp a prirodzená ochrana kože proti UV žiareniu (7). Boli identifikované 2 podozrivé gény, ktoré ovplyvňujú reguláciu cyklín dependentných kináz (CDKN2A) na chromozóme 9p21, sprostredkovane kódujúcom proteín p53 a CDK4 na chromozóme 12q14 (8). Mutácia CDKN2A sa pravdepodobne uplatňuje pri familiárnych a viacpočetných melanómoch. Významným je i fakt, že väčšina melanómových bunkových línií obsahuje mutácie BRAF génu (70 %), ktorý je kľúčovou súčasťou RAS cesty, ktorá zasahuje do odpovedí buniek na expozíciu UV žiarením. RAF kináza je známa aj ako inhibítor apoptózy. Predmetom výskumu sú v posledných rokoch mutácie onkogénov ako BCL-2, BRAF, NRAS a iných. Ich význam spočíva aj v tom, že slúžia ako terapeutické ciele. Z environmentálnych faktorov má dominantnú úlohu UV žiarenie, zvlášť v pásmach UVB (260 – 320 nm) a UVA (320 – 400 nm). Napriek tomu, že presný mechanizmus kancerogenézy indukovanej UV žiarením nie je známy, výskum v posledných rokoch priniesol výrazný vedomostný posun v tejto oblasti.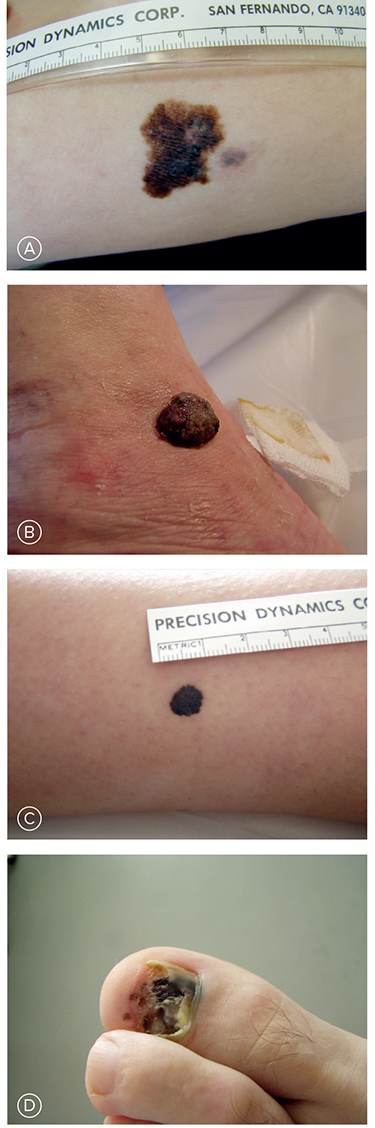
Patogeneticky sa uplatňuje najmä:
• genotoxické poškodenie,
• mitogénny efekt,
• a strata imunologického dohľadu (9).
Transformácia pigmentového névu na melanóm je teda dôsledkom súhry genetických faktorov, expozície UV žiarenia a zmien v mikroprostredí. Molekulovo-biologické metódy výskumu ukazujú, že práve mikroprostredie zohráva významnú úlohu v procese malígnej transformácie melanocytu. Boli opísané zmeny expresie adhéznych molekúl, ako kadheríny a beta-integríny, ktoré uľahčujú inváziu nádorových buniek. Na transformácii a invázii sa zúčastňuje aj hyperexpresia rastových faktorov a cytokínov (bFGF – bázický rastový faktor pre fibroblasty, HGF – rastový faktor pre hepatocyty, PDGF – rastový faktor derivovaný trombocytmi, interleukín-8 a iné) (6, 10, 11).
RIZIKOVÉ FAKTORY
1. Expozícia slnka. Mnoho štúdií potvrdilo vzťah medzi expozíciou slnka a melanómom. Uvádza sa, že až dve tretiny melanómov môžu mať vzťah k expozícii slnka. Zdá sa, že rizikovými skupinami sú osoby s tendenciou k spáleniu kože (fototyp I) a opakovanými epizodickými spáleniami kože do veku 18 rokov (7, 12).
2. Významným faktorom vzniku melanómu je aj počet a veľkosť névov. Počet névov je geneticky determinovaný, ale môže byť modifikovaný expozíciou slnka v detstve. Mansfield uvádza, že prítomnosť piatich névov s priemerom väčším než 6 mm zvyšuje riziko melanómu trojnásobne. Riziko sa naviac zvyšuje s počtom atypických névov (13). Podľa Tuckera zvyšuje prítomnosť jedného dysplastického névu riziko melanómu 2,3-násobne, kým prítomnosť viac než piatich lézií až vyše desaťnásobne. Rizikovým faktorom sú tiež kongenitálne obrovské névy (nad 20 centimetrov) (14).
3. Výskyt melanómu v rodinnej a osobnej anamnéze pacienta. Približne 10 % pacientov má výskyt melanómu u blízkeho príbuzného. Familiárny výskyt melanómu môže byť geneticky determinovaný (napríklad mutácie nádorového supresorového génu CDKN2A). Vzhľadom na anamnestické riziká sa odporúča vyšetrenie príbuzných pacientov s melanómom. Prítomnosť melanómu v osobnej anamnéze je indikáciou na dôslednú dispenzarizáciu ďalších pigmentových lézií.
4. Iné rizikové faktory. Xeroderma pigmentosum je významným, ale – našťastie – veľmi zriedkavým faktorom. Ostatné faktory predstavujú relatívne riziko. Patria sem tehotnosť, vyšší vek, dlhodobá PUVA terapia (viac než 250 aplikácií) a niektoré fenotypové faktory, napríklad fototyp I (15).
DIAGNOSTIKA
Diagnostiku melanómu rozdeľujeme na prebioptickú a bioptickú. Do prebioptickej patria klinické vyšetrenia, dermatoskopické vyšetrenia, sonografia kože a iné neinvazívne zobrazovacie metódy (konfokálna mikroskopia, optická koherentná tomografia). Do bioptickej diagnostiky zaraďujeme dermatohistopatologické vyšetrenie a vyšetrenie sentinelovej lymfatickej uzliny (16).
A. Prebioptická diagnostika
Klinická diagnostika
Diagnostika melanómu v typických prípadoch nerobí problémy. V netypických prípadoch však nezriedka býva zdrojom diagnostických omylov. Urbanček et al. analyzovali výskyt diagnostických omylov melanómu na súbore 936 pacientov. Nesprávna diagnostika bola zachytená v 16 % (17).
Učebnice rozdeľujú štyri základné morfologické typy melanómu (17):
• povrchovo sa šíriaci (60 – 70 %),
• nodulárny (15 – 30 %),
• lentigo maligna melanóm (4 – 10 %),
• akrolentiginózny (2 – 8 %, s vyšším podielom u aziatov a černochov),
• iné, neklasifikovateľné.
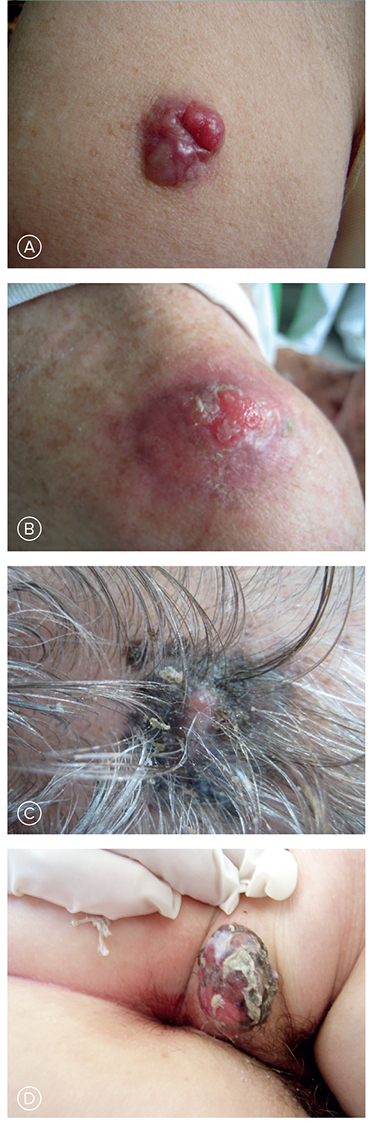
Z atypických foriem robí najväčšie problémy amelanotický melanóm. Diagnostické ťažkosti môžu spôsobiť aj atypické lokalizácie, napríklad v kapilíciu a na slizniciach. Príklady atypických melanómov sú zobrazené na Obrázku č. 4.
Dermatoskopia
Dermatoskopia (syn. epiluminiscenčná mikroskopia, povrchová svetelná mikroskopia) je od 90. rokov široko používanou neinvazívnou in vivo metódou a dnes sa považuje za rutinné vyšetrenie (20).
Princíp dermatoskopie je analogický, ako u otoskopie, tak aj u endoskopických metód. Dermatoskop je lupa, ktorá vďaka osvetleniu a 10 – 20-násobnému zväčšeniu zobrazuje štruktúry, ktoré nie sú viditeľné voľným okom. Zvýraznenie zmien v hlbších vrstvách epidermis, dermoepidermálnej junkcii a papilárnej dermis uľahčuje použitie imerzie (19). Dermatoskopy používajú – v závislosti od typu prístroja – polarizované aj nepolarizované svetlo. Kým nepolarizované svetlo zobrazuje lepšie povrchové štruktúry, polarizované svetlo nezobrazuje horných 0,06 – 0,1 mm kože a používa sa na detekciu hlbšie uložených štruktúr, akými sú kolagénové zväzky alebo cievy.
Dermatoskopia zvyšuje diagnostickú senzitivitu melanómov o 10 – 27 % a významne znižuje počet zbytočne excidovaných benígnych lézií (21, 22, 23). Vo Vestergaardovej štúdii bola diagnostická presnosť záchytnosti melanómu dermatoskopom 90 %, voľným okom iba 74 % (21).
Dermatoskopická diagnostika v sebe zahŕňa tri aspekty: kognitívny aspekt predstavujúci hodnotenie celkových vlastností lézie, komparatívny aspekt predstavujúci evolúciu lézie (tzv. fenomén škaredého káčatka) a interaktívny, umožňujúci porovnanie nedávnych zmien (24). Dermatoskopická diagnostika má dva základné kroky. Prvým krokom je diferenciácia pigmentovej a nepigmentovej lézie. Chen uvádza 85-percentnú senzitivitu a 94-percentnú špecificitu prvého kroku (25).
Druhým krokom je posúdenie benígneho či malígneho charakteru pigmentovej lézie (Obrázok č. 5).
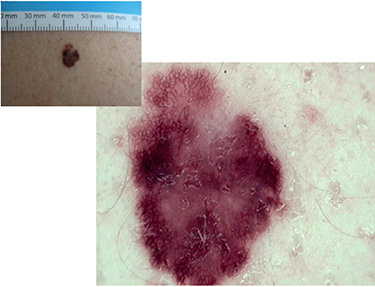
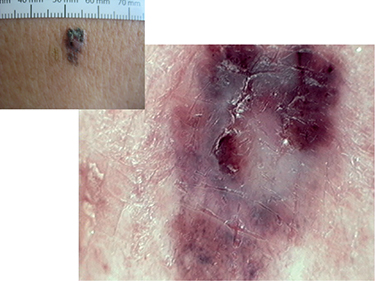
• pigmentová sieť, zodpovedajúca uloženiu melanínu v bazálnych častiach epidermálnych výbežkov,
• globuly/dlaždice zodpovedajúce dermálnym papilám obsahujúcimi hniezda melanocytov – névocytov,
• radiálne pruhy typické pre Reedov névus,
• bezštruktúrne namodralé okrsky, vyskytujúce sa najmä pri modrom néve.
Príklady dermatoskopických obrazov sú uvedené na Obrázkoch č. 6 a 7.
Najjednoduchšie a v praxi najpoužívanejšie hodnotenie dermatoskopického nálezu sa robí na základe pravidiel ABCD (asymetry, border, color, diameter), ktoré sa kvantifikujú a násobia príslušným koeficientom. Výsledok je súčtom jednotlivých položiek a označuje sa ako celkové dermatoskopické skóre – TDS (26). Keďže sú skórovacie systémy v bežnej praxi časovo náročné a použiteľné iba obmedzene, diagnostika sa stanovuje na základe morfologickej analýzy lézie, tzv. pattern analysis. To okrem dobrých znalostí dermatoskopickej morfológie vyžaduje aj, samozrejme, veľkú skúsenosť. Zatiaľ čo u trénovaných dermatológov zvyšuje dermatoskopia diagnostickú presnosť detekcie melanómu bez významnejšieho predĺženia doby vyšetrenia, u netrénovaných lekárov môže správnu diagnostiku naopak redukovať (28). Dobrou a časovo nenáročnou metódou vhodnou na skríning aj kontrolné vyšetrenia u pacientov s veľkým počtom névov je celotelová fotografia, ktorá sa na Slovensku nevykonáva (27).
Sonografia kože
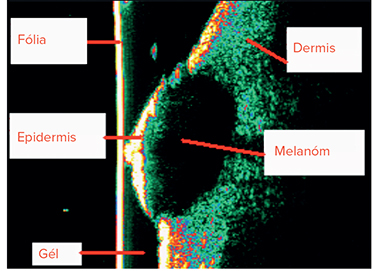
Iné vyšetrovacie metódy
Reflexná konfokálna mikroskopia (RCM). Ide o vyšetrenie epidermy a papilárnej dermy in vivo s výsledkom približujúcim sa histologickému obrazu. Nízkoenergetický laser sa aplikuje bodovo a deteguje svetelný bodový odraz cez dierkovaný filter. Robia sa série horizontálnych rezov hrubé 2 – 5 µm, maximálne do 200 – 300 µm, t. j. do papilárnej dermis. RCM s použitím optického vlákna využíva buď odrazový spôsob na základe rozdielneho odrazu štruktúr melanozómov a melanínu, alebo fluorescenčný spôsob, pri ktorom je rozdielna distribúcia špecifických protilátok značkovaných fluoresceínom. Melanín a melanocyty sú vhodnými cieľovými štruktúrami na detekciu konfokálnym mikroskopom. RCM sa využíva ako doplnková, druholíniová diagnostická metóda k dermatoskopickému vyšetreniu (29). V súčasnosti sú už vypracované algoritmy na diagnostiku melanómu pomocou RCT. Napriek tomu, že ide o sľubnú metódu, nevýhodou je vysoká cena prístroja a potreba dlhodobého tréningu vyšetrujúceho. Vyšetrovacia metóda je viazaná na niekoľko európskych centier. Metaanalýza uvedenej vyšetrovacej metódy udáva senzitivitu 93 % a špecificitu 76 % (30).
Optická koherentná tomografia a magnetická rezonancia kože sú v súčasnosti skôr experimentálnymi metódami, ktoré sú viazané na vysokošpecializované pracoviská. Nepredpokladá sa ich výraznejšia penetrácia do rutinnej praxe.
B. Bioptická diagnostika
Histopatologická diagnostika melanómu je základným predpokladom optimálnej liečby. Vyžaduje úzku spoluprácu klinika a patológa. Hodnotenie nálezu skúseným dermatohistopatológom, erudovaným v uvedenej oblasti a rešpektujúcim aktuálne poznatky, prináša klinikovi najcennejšie diagnostické informácie.
Histopatologický záver by mal obsahovať nasledujúce parametre:
1. histologický podtyp nádoru,
2. hrúbka nádoru v milimetroch (Breslow) – najdôležitejší prognostický znak,
3. hĺbka invázie podľa Clarka (Tabuľka č. 1) – okrem niektorých špeciálnych prípadov stanovenie nemá význam,
4. prítomnosť/neprítomnosť ulcerácie,
5. horizontálna/vertikálna fáza rastu,
6. intenzita lymfocytárneho infiltrátu,
7. mitotický index (počet mitóz na mm2),
8. prítomnosť lymfatického/cievneho šírenia +- perineurálne šírenie,
9. prítomnosť/neprítomnosť regresie,
10. prítomnosť zvyškov névových štruktúr.
Príklady histopatologického obrazu melanómu sú na Obrázkoch č. 9 a 10.
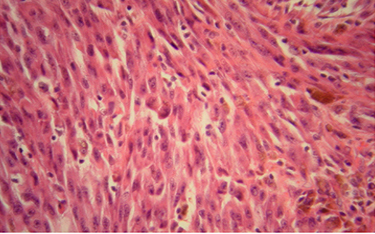

V prípadoch, keď pri základnom farbení hematoxylínom–eozínom nie je možné stanoviť diagnózu (napr. amelanotický, dezmoplastický melanóm, malobunkové nádory), je indikované imunohistochemické vyšetrenie. Najčastejšie používané imunohistochemické markery sú proteín S-100 a monoklonálne protilátky proti HMB-45, Melan A/Mart-1 a Ki-67. Každé z imunohistochemických farbení má špecifický diagnostický význam. V ostatných rokoch sa vyvíjajú molekulovo-genetické invazívne a neinvazívne metodiky zvyšujúce diagnostickú presnosť. Experimentálne bol vyvinutý náplasťový neinvazívny test detegujúci mRNA dvoch melanóm špecifických génov, budúcnosť ukáže jeho potenciálne využitie v praxi (31).
V súvislosti so vstupom nových cielených terapií nadobúda čoraz väčší význam molekulová typizácia melanómu. Medzi najčastejšie patrí vyšetrenie mutácií onkogénov, respektíve protoonkogénov BRAF, obmedzene aj MEK, PD1-ligandu a c-kit v primárnych tumoroch aj v metastatických ložiskách.
Vyšetrenie sentinelovej lymfatickej uzliny bolo zavedené začiatkom 90. rokov ako minimálne invazívna metóda a dnes patrí k štandardným diagnostickým postupom (34). Ide o vyšetrenie „subklinickej“, klinickým vyšetrením nedetegovateľnej mikrometastázy v regionálnej lymfatickej uzline. V súčasnosti sa vykonáva dvojkroková metóda. V prvej fáze sa aplikuje značkované technécium Tc99 perilezionálne v oblasti melanómu, ktoré sa deponuje v uzline. Peroperačne sa uzlina deteguje gamakamerou a označí sa koloidným roztokom metylénovej modrej. Exstirpovaná uzlina sa následne vyšetrí štandardne histologicky a imunohistochemicky, prípadne senzitívnejšími metódami, napríklad reverse-transcriptase PCR (RT-PCR). Potreba vyšetrenia sentinelovej lymfatickej uzliny bola dlhodobo predmetom diskusií v rámci odborných kruhov. V súčasnosti je vyšetrenie sentinelovej uzliny inkorporované do AJCC klasifikácie a považuje sa za štandard (33). Odporcovia tejto vyšetrovacej metódy argumentovali nevýznamnými rozdielmi v celkovom prežívaní, či rizikom iatrogénneho poškodenia. Johnson uvádza nižší výskyt metastáz po včasnej exstirpácii pozitívnej sentinelovej uzliny a následnej kompletnej disekcii lymfatických uzlín – voči skupine, ktorá bola iba sledovaná – a uvádza aj vyššie celkové prežívanie (34). Vyšetrenie sentinelovej uzliny nezvyšuje riziko intranzitných metastáz. Viaceré práce potvrdili, že vyšetrenie sentinelovej uzliny je významný prognostický faktor intervalu bez recidívy aj celkového prežívania, od ktorého sa odvíja ďalšia liečebná stratégia (35). Porovnanie celkového prežívania na základe hrúbky nádoru (Breslow) a vyšetrenia sentinelovej uzliny je uvedené v Tabuľke č. 2.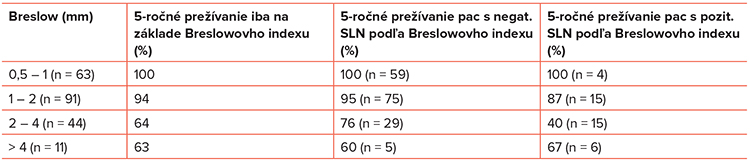
ZÁVER
Diagnostika melanómu sa v priebehu ostatných rokov posunula na vyššiu úroveň. Vo vzťahu k cieleným terapiám a imunoterapiám sa hovorí o tzv. teragnostics, terapii previazanej s diagnostikou. Diagnostické omyly však aj napriek zavedeniu moderných inštrumentálnych vyšetrovacích metód nie sú zriedkavosťou. V zahraničí je trend hodnotiť presnosť diagnostiky špecializovaných pracovísk pomocou rôznych štatistických nástrojov, napríklad melanómového diagnostického indexu. Z toho vyplýva potreba intenzívnejšej a systematickej edukácie dermatológov, chirurgov a praktických lekárov.
Literatúra
- Krajsová, I.: Melanom. Praha, Maxdorf, 2006
- American Cancer Society. Cancer Facts & Figures. American Cancer Society, Inc., 2002
- Marks, R.: Epidemiology of melanoma. What’s new? World congress Cancers of the skin. Amsterdam, 2007
- Incidence of melanoma of the skin. Stiahnuté 8. 1. 2015
- Urbanček S., Dolinský J.: kapitoly Malígny melanóm) IN: Jurga Ľ. a kol.: Klinická a radiačná onkológia. Martin, Osveta, 2010, 1213 – 33
- Liu, Z., Herlyn, M.: Molecular biology of Cutaneous melanoma. In: DeVita, V. T., Hellman, S. M. D., Rosenberg, S.: Cancer Principles and Practice of Oncology, 7/ed., Lippincott Williams and Wilkins, 2005, 1745 – 1753
- Armstrong, B. K., Kricker, A.: How much melanoma is caused by sun exposure? Melanoma Res., 1993, 3: 395
- Gruijl, F. R.: IL-40 UV carcinogenesis and melanocytes. Pigment Cell Res., 2003, 16: 591
- Elwood, J. M., Jopson, J.: Melanoma and sun exposure: an overview of published studies. Int. J. Cancer 73, 1997, 198
- Nesbit, M., Nesbit, H. K., Bennett, J. et al.: Basic fibroblast growth factor induces a transformed phenotype in normal human melanocytes. Oncogene, 1999, 18: 6469
- Shih, I. M., Speicher, D., Hsu, M. Y. et al.: Melanoma cell-cell interactions are mediated through heterophilic Mel-CAM/ligand adhesion. Cancer Res., 1997, 57: 3835
- Green, A.: Sun exposure and the risk of melanoma. Australas J. Dermatol., 1984, 25: 99
- Mansfield, P. F., Lee, J. E., Balch, C. M.: Cutaneous melanoma: current practice and surgical controversies. Curr. Probl. Surg., 1994, 31: 253
- Tucker, M. A. et al.: Clinically recognized dysplastic nevi. A central risk factor for cutaneous melanoma. JAMA, 1997, 277: 1 439. 62.1
- Stern, R. S., Nichols, K. T., Vakeva, L. H.: Malignant melanoma in patients treated for psoriasis with methoxsalen (psoralen) and ultraviolet A radiation (PUVA). The PUVA Follow-Up Study. N. Engl. J. Med., 1997, 336: 1041
- Urbanček, S., Minariková, E.: Diagnostika malígneho melanómu. Onkológia 8, 2013, 142 – 146
- Urbancek, S., Fedorcova, P., Tomkova, J., Sutka, R.: Misdiagnosis of Melanoma: A 7 Year Single-Center Analysis. J Pigmentary Disorders. 2: 208. doi:10.4172/2376-0427.1000208
- Langley, R. G. B., Barnhill, R. L., Mihm, M. C., Fitzpatrick, T. B., Sober, A. J.: Neoplasms: Cutaneous melanoma. IN: Freedberg IM., Eisen AZ., Wolff K., Austen KF., Goldsmith LA., Katz SI.: Fitzpatrick´s Dermatology In General Medicine 6-th ed., New York, McGraw-Hill, 2003, 917 – 47
- Krajsová, I.: Využití dermatoskopie a digitální dermatoskopie v diagnostice melanomu. Dermatol. praxi 5, 2011, 23 – 25
- Zalaudek, I., Kittler, H., Marghoob, A. A., Balato, A., Blum, A., Dalle, S., Ferrara, G., Fink-Puches, R., Giorgio, C. M., Hofmann-Wellenhof, R., Malvehy, J., Moscarella, E., Puig, S., Scalvenzi, M., Thomas, L., Argenziano, G.: Time required for a complete skin examination with and without dermoscopy: a prospective, randomized multicenter study. Arch Dermatol 2008, 144:509 – 513
- Vestergaard, M. E., Macaskill, P., Holt, P. E., Menzies, S. W. Dermoscopy compared with naked eye examination for the diagnosis of primary melanoma: a meta-analysis of studies performed in a clinical setting. Br J Dermatol 2008; 159: 669 – 676
- Carli, P., De Giorgi, V., Crocetti, E. et al. Improvement of malignant ⁄ benign ratio in excised melanocytic lesions in the ‘dermoscopy era’: a retrospective study 1997–2001. Br J Dermatol 2004; 150: 687 – 692
- Mayer, J. Systematic review of the diagnostic accuracy of dermatoscopy in detecting malignant melanoma. Med J Aust 1997; 167: 206 – 210
- Gachon, J., Beaulieu, P., Sei, J. F., Gouvernet, J., Claudel, J. P., Lemaitre, M., Richard, M. A., Grob, J. J. First prospective study of the recognition process of melanoma in dermatological practice. Arch Dermatol 141, 2005, 434 – 38
- Chen, L. L., Dusza, S. W., Jaimes, N., Marghoob, A. A.: Performance of the First Step of the 2-Step Dermoscopy Algorithm. JAMA Dermatol 151, 2015, 715 – 721
- Pock, L., Fikrle, T., Drlik, L., Zloský, P. Dermatoskopicky atlas. Praha, Phlebomedica s. r. o. 2008: 149 s.
- Dengel, L. T., Petroni, G. R., Judge, J., Chen, D., Acton, S. T., Schroen, A. T., Slingluff, C. L.: Total body photography for skin cancer screening. International Journal of Dermatology 2015, 54, 1250 – 1254
- Boespflug, A.,Guerra, J., Dalle, S., Thomas, L.: Enhancement of Customary Dermoscopy Education With Spaced Education e-Learning A Prospective Controlled Trial. JAMA Dermatol. 151, 2015, 847 – 853
- Stevenson, A. D., Mickan, S., Mallett, S., Ayya, M.: Systematic review of diagnostic accuracy of reflectance confocal microscopy for melanoma diagnosis in patients with clinically equivocal skin lesions. Dermatol Pract Concept 3, 2013; 19 – 27
- Marghoob, A. A., Swindle, L. D., Moricz, C. Z., Sanchez Negron, F. A., Slue, B., Halpern, A. C., Kopf, A. W.: Instruments and new technologies for the in vivo diagnosis of melanoma. J Am Acad Dermatol 49, 2003, 777 – 97
- Gerami, P., Alsobrook, P. D., Palmer, T. J., Robin HS.: Development of a novel noninvasive adhesive patch test for the evaluation of pigmented lesions of the skin. J Am Acad Dermatol 71, 2014, 237 – 44
- Minariková, E., Péč, J., Plank, L., Bobrovská, M., Strmeňová, V., Chromej, I.: Predoperačné stanovenie hrúbky melanómu s použitím 20MHz sonografie. Čes.-slov.Derm 82, 2007, 136 – 39
- Balch, C. M., Gershenwald, J. E., Soong, S., Thompson, J. F., Atkins, M. B., Byrd, D. R., Buzaid, A. C., Cochran, A. J., Coit, D. G., Ding, S., Eggermont, A. M., Flaherty, K. T., Gimotty, P. A., Kirkwood, J. M., McMasters, K. M., Mihm, M. C. Jr., Morton, D. L., Ross, M. I., Sober, A. J., Sondak, V. K.: Final Version of 2009 AJCC Melanoma Staging and Classification. J Clin Oncol 27, 2009, 6199 – 6206
- Johnson, T. M., Bradford, C. R., Gruber, S. B., Sondak, V. K., Schwartz, J. L. Staging work-up, sentinel node biopsy and follow-up tests for melanoma: update of current concepts. Arch Dermatol. 140, 2004, 107 – 113
- Stebbins, W. G., Garibyan, L., Sober, A. J.: lymph node biopsy and melanoma: 2010 update. Part I. J Am Acad Dermatol 62, 2010, 723 – 34
- Vuylsteke, R. J., van Leeuwen, P. A., Statius Muller, M. G., Gietema, H. A., Kragt, D. R., Meijer, S. Clinical outcome of stage I/II melanoma patients after selective sentinel lymph node dissection: longterm follow-up results. J Clin Oncol 21, 2003, 1057 – 65








