Stres sprevádza život na zemi už od jeho prvopočiatkov. Preto sa u organizmov vyvinuli komplexné systémy stresovej reakcie, medzi ktorými má ústredné postavenie neuroendokrinná stresová reakcia. Adekvátna neuroendokrinná reakcia predstavovala a predstavuje jeden zo zásadných faktorov umožňujúcich organizmu prežiť pôsobenie stresorov. Prečo potom ale stresová reakcia, ktorá je z fylogenetického hľadiska tak prospešná, sa v súčasnosti u človeka stáva skôr poškodzujúcou a dáva sa do súvisu so vznikom a progresiou celého spektra chorôb, od kardiovaskulárnych, metabolických, imunitných a onkologických až po neurologické a psychiatrické? Zdá sa, že je to podmienené predovšetkým zmenou v zastúpení typov stresorov, ktoré v súčasnosti na človeka pôsobia a tým, ako ľudia na pôsobenie stresorov reagujú.
Stres, stresor, stresová reakcia
Aj napriek tomu, že pojem stres sa používa pomerne často, nie vždy sa používa v správnom kontexte. Ako stresor sa označuje podnet, ktorý aktivuje stresovú reakciu. Ako stres potom možno označiť stav, respektíve reakciu organizmu na pôsobenie stresora. Aj keď sa výskumu stresu venuje pomerne veľká pozornosť, stále neexistuje všeobecne akceptovaná definícia stresovej reakcie. Vo všeobecnosti ale možno stresovú reakciu charakterizovať ako reakciu, ktorú vyvolá vonkajší alebo vnútorný podnet, ktorého intenzita presiahla úroveň, keď sú ešte dostačujúce bežné kompenzačné mechanizmy. Príkladom takýchto podnetov je vzostup teploty na hodnoty charakteristické pre trópy alebo strata väčšieho objemu krvi.
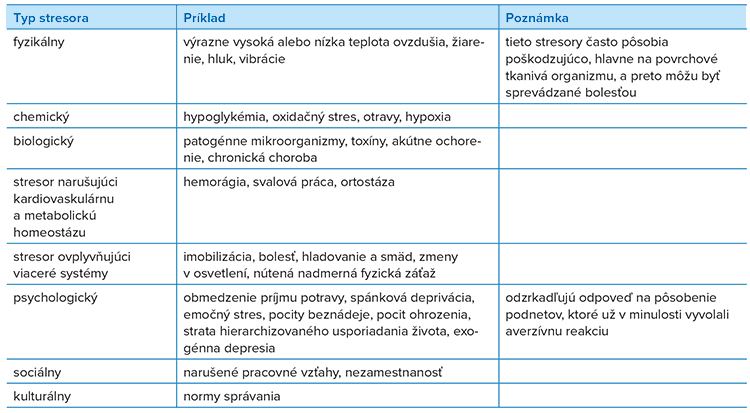
U ľudí ako stresor pôsobí napríklad zvýšené množstvo osôb v okolí jedinca alebo naopak sociálna izolácia, konkurenčné vzťahy, hluk, fyzikálne a chemické škodliviny a patogénne mikroorganizmy (viď Tabuľka č. 1). Obzvlášť pre ľudskú spoločnosť sú charakteristické špecifické a vysoko komplexné sociálne interakcie. Tieto interakcie sú často spojené s psychologickými stresormi (viď Tabuľka č. 2).

Pozitívne a negatívne dôsledky stresu
Zatiaľ čo krátkodobá aktivácia stresovej reakcie je pre organizmus nevyhnutná na zvládnutie záťažových situácií, nadmerná a opakovaná aktivácia stresovej reakcie má na činnosť organizmu nepriaznivý dopad. V súčasnom období pôsobia stresory na jedincov často chronicky, pričom dlhodobé a nadmerné pôsobenie stresorov má na činnosť organizmu preukázateľne nepriaznivý vplyv. Opakovaná a nadmerná aktivácia stresovej reakcie sa podieľa na etiopatogenéze viacerých závažných chorôb (napr. kardiovaskulárnych, metabolických, neuropsychiatrických).
Stres však nie je faktor, ktorý pôsobí na organizmus iba negatívne, poškodzujúco a nie vždy musí byť pociťovaný ako nepríjemný (distres). Počas stresovej reakcie sa mobilizujú energetické zdroje (glukóza, mastné kyseliny), ktoré sú pre organizmus dôležité pre vykonanie adekvátnej fyzickej aktivity, dochádza tiež k aktivácii mozgových štruktúr, čo zasa zabezpečuje primeraný psychický výkon, čo je potrebné pre zvládnutie záťažových situácií. Jedným z príkladov pozitívneho pôsobenia stresu je fyzická aktivita spojená s cvičením, ktoré okrem iného stimuluje kostnú osteoblastickú aktivitu a kalcifikáciu potrebnú pre zvyšovanie kostnej denzity, a tým pevnosti kostí. Prospešný vplyv primeranej fyzickej aktivity pre kardiovaskulárny systém a metabolizmus je ďalším príkladom pozitívne pôsobiaceho stresora. Takýto stres zvyšuje aj mentálnu a fyzickú kondíciu, čím zvyšuje výkon a produktivitu a môže byť pociťovaný ako príjemný, pozitívny alebo vzrušujúci (eustres). Stres, ako neoddeliteľná súčasť života ľudí teda predstavuje na jednej strane esenciálnu zložku života, na druhej strane, ak je neprimeraný, môže predstavovať poškodzujúci faktor vedúci k maladaptačným reakciám.
Systémy stresovej reakcie
Stresová reakcia vyšších organizmov predstavuje koordinovanú aktiváciu mnohých eferentných nervových a humorálnych dráh. Ústrednými efektorovými zložkami neuroendokrinných systémov stresovej reakcie sú sympatikový nervový systém a nadoblička (viď Obrázok č. 1). Nadobličku tvoria dve endokrinné žľazy a vonkajšia kôra, ktorá obklopuje vnútornú dreň. Hlavnými hormónmi syntetizovanými a uvoľňovanými z drene sú katecholamíny (adrenalín, noradrenalín, v malej miere aj dopamín), kôra nadobličiek syntetizuje a uvoľňuje steroidné hormóny. Zatiaľ čo dreň nadobličky je adrenomedulárnou hormonálnou zložkou sympatikoadrenálneho systému, kôra nadobličky je efektorovou zložkou hypotalamo-hypofýzo-adrenokortikálnej (HPA) osi.
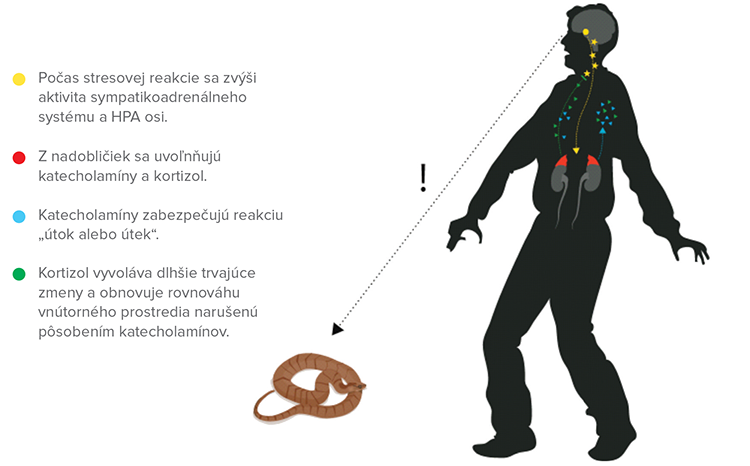
Zvýšená aktivita sympatikoadrenálneho systému a HPA osi počas stresovej reakcie podmieňuje vzostup plazmatických hladín katecholamínov a glukokortikoidov. Obidva efektorové systémy majú centrálnu a periférnu časť. Sympatikoadrenálny systém a HPA os sú anatomicky a funkčne prepojené a počas stresovej reakcie interagujú na rôznych úrovniach. Napríklad hormóny HPA ovplyvňujú aktivitu sympatikoadrenálneho systému na úrovni mozgu, hypofýzy a drene nadobličiek. Integračnými zložkami systémov regulujúcich činnosť organizmu počas pôsobenia stresorov sú skupiny neurosekrečných neurónov v nucleus paraventricularis hypothalami, ktoré aktivujú HPA prostredníctvom uvoľňovania kortikoliberínu a neuróny nucleus paraventricularis hypothalami, laterálneho hypotalamu a mozgového kmeňa, ktorých axóny priamo inervujú sympatikové pregangliové neuróny, a tým regulujú aktivitu sympatikoadrenálneho systému.
Sympatikoadrenálny systém
Regulačné centrum sympatikoadrenálneho systému tvorí viacero mozgových štruktúr, z ktorých k najvýznamnejším patria hypotalamické oblasti (napr. nucleus paraventricularis, laterálny hypotalamus). Počas pôsobenia emočných stresových podnetov je činnosť hypotalamu modulovaná prevažne descendentnými dráhami z kôrových oblastí a limbického systému. Naproti tomu je pri pôsobení fyzikálnych stresorov činnosť hypotalamu modulovaná prevažne ascendentnými dráhami z mozgového kmeňa (hlavne z monoamínergických neurónov). Hypotalamus následne prostredníctvom descendentých dráh vedúcich do mozgového kmeňa (napr. k C1 skupine neurónov syntetizujúcich adrenalín) a miechy (intermediolaterálny stĺpec, v ktorom sa nachádzajú telá sympatikových pregangliových neurónov) moduluje činnosť sympatikových nervov a drene nadobličiek. Aktivácia sympatikových nervov vedie k uvoľneniu noradrenalínu z nervových zakončení v inervovaných tkanivách. Zvýšená aktivácia drene nadobličiek zasa podmieňuje vyplavenie adrenalínu a v menšej miere aj noradrenalínu z chromafinných buniek do systémovej cirkulácie.
Katecholamíny uvoľnené z drene nadobličiek a sympatikových nervových zakončení počas pôsobenia stresorov ovplyvňujú činnosť väčšiny orgánov tela. Pôsobia pozitívne inotropne, chronotropne a vyvolávajú vazokonstrikciu v splanchnickej oblasti a koži. Výrazná aktivácia sympatikoadrenálneho systému počas stresu preto spôsobuje zvýšenie krvného tlaku prostredníctvom zvýšenia periférnej cievnej rezistencie a zvýšeného srdcového výdaja. Pri aktivácii sympatikových nervov dochádza k redistribúcii krvi so zvýšením prekrvenia svalstva a zníženým prekrvením splanchnických oblastí a kože. Stresom aktivovaný sympatikoadrenálny systém zapríčiňuje rozšírenie zreníc (mechanizmus, ktorý uľahčuje sledovanie situácie v blízkom okolí), zvyšuje produkciu potu (uľahčuje odvádzanie tepla z organizmu do okolia), spôsobuje piloerekciu, inhibuje vylučovanie sodíka v obličkách (retencia vody) a moduluje tonus kostrového svalstva. Dochádza aj k zvýšenej agregabilite krvných doštičiek (ako protektívny mechanizmus v prípade poranenia). Katecholamíny ovplyvňujú aj energetický metabolizmus stimuláciou glykogenolýzy v pečeni a lipolýzy v tukovom tkanive. Katecholamíny uvoľnené na periférii počas pôsobenia stresových podnetov majú v konečnom dôsledku za cieľ pripraviť organizmus na vykonanie intenzívnej svalovej práce na základe redistribúcie a zvýšenej oxygenácie krvi, ako aj dostupnosti energetických substrátov.
Periférne uvoľnené katecholamíny neprechádzajú hemato-encefalickou bariérou, preto nemôžu priamo ovplyvniť činnosť neurónov centrálneho nervového systému. V dôsledku pôsobenia stresorov sa ale uvoľňujú katecholamíny z monoamínergických neurónov mozgového kmeňa (napr. locus coeruleus), ktoré zabezpečujú primeranú reakciu na stresový podnet ovplyvnením bdelosti, pozornosti, pamäte a vnímania bolesti.
Hypotalamo-hypofýzo-adrenokortikálna os
Kortikotropín uvoľňujúci hormón (CRH) je centrálnym faktorom neuroendokrinnej reakcie sprostredkovanej HPA osou. CRH uvoľnený z hypotalamu indukuje sekréciu adrenokortikotropného hormónu (ACTH) z predného laloka hypofýzy. ACTH následne stimuluje syntézu a sekréciu glukokortikoidov (napr. kortizolu) z kôry nadobličiek.
Glukokortikoidy majú mnoho priamych a nepriamych fyziologických účinkov, ktoré sprostredkúvajú stresovú reakciu, zvyšujú aktivitu iných hormónov, alebo tlmia iné zložky stresového systému. Z tohto pohľadu kortizol účinkuje na jednej strane ako mediátor stresovej reakcie a na druhej strane ako inhibítor stresovej reakcie, čím zabraňuje nadmernej aktivácii stresovej reakcie.
Zvýšené plazmatické hladiny glukokortikoidov ovplyvňujú činnosť väčšiny tkanív, ale v porovnaní s katecholamínmi je nástup ich účinku oneskorený. Glukokortikoidy stimulujú glukoneogenézu, glykogenogenézu a pôsobia proteokatabolicky. Tieto účinky majú za cieľ prispieť k zachovaniu energetickej rovnováhy narušenej vplyvom procesov indukovaných katecholamínmi v počiatočných fázach stresovej reakcie. Glukokortikoidy ovplyvňujú aj funkciu imunitného systému svojím protizápalovým a imunosupresívnym vplyvom. Dlhodobo zvýšené plazmatické hladiny glukokortikoidov pri pôsobení chronického stresu sa môžu podieľať na vzniku gastrointestinálnych lézií a na zvýšenej senzitivite kardiovaskulárneho systému na katecholamíny.
Glukokortikoidy na rozdiel od katecholamínov prechádzajú mozgovo-cievnou bariérou. V mozgu pôsobia na glukokortikoidové, ale aj mineralokortikoidové receptory. Predpokladá sa, že chronický stres môže práve prostredníctvom centrálneho pôsobenia glukokortikoidov viesť k zmenám v činnosti centrálneho nervového systému, ktoré sa môžu prejaviť aj narušením psychických procesov. Experimentálne údaje poukazujú na negatívny vplyv glukokortikoidov na plasticitu neurónov, ako aj na neurogenézu. Znížená plasticita neurónov, pozorovaná hlavne v hipokampe, môže pôsobiť ako jeden z etiopatogenetických faktorov pri vzniku neuropsychiatrických ochorení.
Ďalšie endokrinné systémy zapojené v stresovej reakcii
Okrem katecholamínov a glukokortikoidov sa počas stresovej reakcie mení sekrécia aj ďalších hormónov (napr. antidiuretický hormón, renín-angiotenzín-aldosterónový systém, rastový hormón, prolaktín, tyreoidálny hormón a reprodukčné hormóny). Systémy zodpovedné za reprodukciu, rast a imunitu sú priamo spojené so stresovým systémom a hormonálne účinky stresových reakcií výrazne ovplyvňujú tieto systémy. Antidiuretický hormón (ADH, vazopresín) je zapojený do stresovej reakcie, najmä pri pôsobení hypotenzívnych stresorov alebo stresorov vedúcich k strate objemu telesných tekutín. ADH zvyšuje zadržiavanie vody obličkami, vyvoláva vazokonstrikciu krvných ciev a pôsobí synergicky s CRH stimulačne na vyplavovanie ACTH.

Renín-angiotenzín-aldosterónový systém (RAAS) je jedným z najúčinnejších efektorových systémov podieľajúcich sa na zadržiavaní sodíka v organizme. Stimulom pre uvoľňovanie renínu je zvýšená aktivita sympatikových nervov inervujúcich obličku, zníženie perfúzneho tlaku v obličkách, pokles renálnej tubulárnej koncentrácie sodíka a pokles plniaceho tlaku srdca. Spojenie medzi aktivitou sympatikoadrenálneho systému a RAAS je podmienené aj tým, že obidva systémy zdieľajú spoločné efektory (vysokotlakové aj nízkotlakové baroreflexné systémy). Existuje pozitívna korelácia medzi plazmatickými hladinami noradrenalínu a renínovou aktivitou, pričom tento vzťah je zreteľný hlavne u jedincov s esenciálnou hypertenziou. Hladiny rastového hormónu v krvi sa zvyšujú po pôsobení viacerých stresujúcich fyzických alebo psychologických podnetov, ako sú napríklad vyčerpávajúca fyzická aktivita a extrémny strach. Vo väčšine situácií sa paralelne so zvýšením hladín rastového hormónu zvyšujú aj hladiny kortizolu. Aj keď je rastový hormón na začiatku pôsobenia stresorov zvýšený, dlhotrvajúca prítomnosť kortizolu vedie k potlačeniu sekrécie rastového hormónu, somatomedínu C a ďalších rastových faktorov, čo má za následok inhibičný účinok na rast organizmu. Naviac CRH priamo zvyšuje uvoľňovanie somatostatínu v hypotalame, čím inhibuje sekréciu rastového hormónu.
Plazmatické hladiny prolaktínu môžu byť zvýšené viacerými druhmi stresorov. V porovnaní s rastovým hormónom vykazujú hladiny prolaktínu iba malé zmeny po fyzickej záťaži. Avšak podobne ako pri rastovom hormóne, aj zvýšenie hladín prolaktínu vyžaduje podnety, zvyčajne intenzívnejšie, ako tie, ktoré sú potrebné pre vzostup plazmatických hladín katecholamínov alebo kortizolu.
Stresom indukovaná sekrécia kortizolu je spojená s poklesom hladín tyreostimulačného hormónu a inhibíciou premeny tyroxínu na biologicky aktívnejší trijódtyronín v periférnych tkanivách. Dochádza tým k šetreniu energie počas stresových situácií.
Reprodukčné hormóny sú inhibované pôsobením CRH na úrovni hypofýzy a pôsobením kortizolu na úrovni hypofýzy, gonád a cieľových tkanív. Sepsa a závažná trauma môžu vyvolať anovuláciu a amenoreu u žien a znížiť spermatogenézu a hladinu testosterónu u mužov.
Stres a choroby

Pre prehistorických predkov človeka, ktorí žili v relatívne nehostinnom a nebezpečnom prostredí, nebola stresová reakcia iba primeraným, ale v skutočnosti kritickým faktorom umožňujúcim ich prežitie. V tomto období prevažovalo pôsobenie fyzikálnych stresorov (napr. chlad, bolesť), ktoré pôsobili zväčša akútne, pričom neuroendokrinná stresová reakcia zabezpečovala primeranú mobilizáciu energetických zdrojov, potrebných pre vykonanie svalovej práce spojenej s reakciou „útok alebo útek“.
V modernej histórii ľudstva došlo k tak výrazným zmenám v spektre pôsobiacich stresorov ako aj v reakciách jedincov na ne, že adaptačná stresová reakcia sa často stáva reakciou maladaptačnou. Vo vyspelých krajinách v súčasnosti pôsobia na ľudí prevažne psychosociálne stresory (napr. interpersonálne konflikty). Psychosociálne stresory pritom aktivujú neuroendokrinnú stresovú reakciu, ktorá bola pôvodne zameraná na zabezpečenie primeranej fyzickej a psychickej aktivity potrebnej na zvládnutie záťažovej situácie. Avšak stresová reakcia moderného človeka prebieha často bez primeranej fyzickej aktivity, čím nedochádza k adekvátnemu využitiu mobilizovaných energetických zdrojov. Nesúlad medzi geneticky „naprogramovanou“ neuroendokrinnou stresovou reakciou a moderným životným štýlom tak predstavuje významný faktor, podieľajúci sa na vzniku širokého spektra chorôb. Tak napríklad chronické zvýšenie plazmatických hladín glukokortikoidov sa môže v dôsledku ich modulačného vplyvu na metabolizmus sacharidov, lipidov a proteínov podieľať na vzniku metabolických porúch, imunosupresívne pôsobenie glukokortikoidov môže podmieňovať poruchy imunitných funkcií, centrálne pôsobenie glukokortikoidov zase môže znižovať plasticitu v centrálnom nervovom systéme, a tým sa podieľať na vzniku afektívnych porúch. Zvýšená aktivita sympatikových nervov sa môže podieľať na vzniku hypertenzie, zvýšené hladiny katecholamínov môžu pôsobiť stimulačne na nádorovú proliferáciu.
Je však potrebné podotknúť, že jedinci sa môžu výrazne líšiť v tom, ako interpretujú, pociťujú a následne reagujú na daný psychosociálny alebo fyzický stresor. Zatiaľ čo pre niekoho môže byť daný podnet stresujúci, iný ho môže pociťovať len ako bežný alebo dokonca pozitívny. Takéto interindividuálne rozdiely v kognitívnom spracovaní signálov súvisiacich s pôsobením stresorov predstavujú faktor, ktorý významnou mierou sťažuje výskum zaoberajúci sa negatívnym vplyvom stresorov na zdravie človeka. Určiť význam pôsobenia stresorov pri vzniku chorôb u človeka predstavuje veľmi komplexný problém. Genetické vplyvy, intrauterinné prostredie, zážitky v ranom detstve, vzdelanie, rodinné a sociálne zázemie a ďalšie faktory podmieňujú, že nie je možné jednoznačne spojiť pôsobenie stresorov a vznik choroby u daného jedinca. Určenie príčinných vzťahov medzi pôsobením stresorov a patologickým procesom komplikuje aj fakt, že často je prítomný zvyčajne dlhý časový úsek medzi počiatočnou expozíciou stresoru, stresovou reakciou a manifestáciou choroby.
Výskum stresu
Výskum stresu založený na využívaní zvieracích modelov rozpracoval Hans Selye. Modely stresu, v ktorých sa sleduje vplyv určitého stresora na neuroendokrinné, behaviorálne a ďalšie reakcie u laboratórnych zvierat, zásadnou mierou prispeli k objasneniu mechanizmov stresovej reakcie a jej vplyvu na fyziologické a patologické procesy prebiehajúce v organizme. Rozvoj molekulárnych a zobrazovacích metód umožnil výrazný pokrok vo výskume stresovej reakcie, ku ktorému došlo v posledných desaťročiach. Medzi používané modely stresu patria napríklad imobilizácia, hypokinéza, výpary éteru a expozícia predátorovi. Využíva sa aj model, ktorý je analógiou pôsobenia rôznych stresorov na ľudí, keď sa zviera exponuje v náhodnom poradí rôznym typom stresorov, ako sú hluk, zmeny osvetlenia, zmeny sklonu klietky a obmedzenie pohybu.
V porovnaní s ostatnými živočíšnymi druhmi vykazujú stresory u ľudí určité špecifiká. V experimentoch na zvieratách možno organizmus exponovať stresoru, pričom odpoveď laboratórnych zvierat môže vykazovať relatívne vysokú mieru zhodnosti. Toto však neplatí pre ľudí. Vyššie kognitívne procesy, genetické faktory, výchova, sociálne a kultúrne faktory spôsobujú, že dvaja jedinci takmer nikdy nereagujú na určitý stresor rovnako. Problémom je aj to, že u ľudí možno len veľmi ťažko exaktne analyzovať typ pôsobiaceho stresora. Je to dôsledkom komplexnosti reakcií, ktorými jedinec na daný stresor reaguje. Napríklad aj keď je jedinec vystavený pôsobeniu chladu, jeho reakcia závisí od veľkého množstva faktorov, medzi ktoré patria predchádzajúce „skúsenosti“ s chladným prostredím, aktuálna fyzická a psychická zdatnosť a motivačné faktory (napr. snaha dosiahnuť vysokohorský vrchol).
Určovanie miery stresu u ľudí
Miera stresu sa u ľudí určuje prevažne na základe detekcie zmien v aktivite sympatikoadrenálneho systému a HPA osi, a to buď pomocou priamych alebo nepriamych metód. Medzi priame metódy patrí určenie plazmatických hladín katecholamínov a glukokortikoidov. V tejto súvislosti je ale potrebné upozorniť, že aj samotný odber krvi predstavuje stresor. Preto je pre exaktné posúdenie aktuálnej aktivity neuroendokrinných systémov stresovej reakcie potrebné jedincovi najprv zaviesť do vény kanylu a odber uskutočniť až po 10 – 15 minútach. Ďalšou priamou metódou je záznam elektrickej aktivity sympatikových nervov pomocou ihlových elektród umiestnených transkutánne. Medzi nepriame metódy patrí sledovanie variability srdcovej frekvencie (umožňuje určiť pomer medzi aktivitou parasympatikového a sympatikového nervového systému), sledovanie zmien kožnej vodivosti alebo určenie koncentrácie kortizolu a α-amylázy v slinách. Ako priame tak aj nepriame metódy sú ale zaťažené viacerými skresľujúcimi faktormi, čo sťažuje exaktné určenie miery stresovej reakcie u ľudí.
Ako znížiť negatívne dôsledky stresu
Nie je možné vyhnúť sa pôsobeniu stresov. Existuje teda možnosť, ako obmedziť ich negatívne pôsobenie na ľudský organizmus? Jednu z možností predstavujú psychologické metódy, príkladom je autogénny tréning. Aj pravidelná fyzická aktivita môže obmedziť negatívne dôsledky stresu. Ako obzvlášť významná sa javí potreba obmedziť stresovú reakciu u pacientov. U pacientov totiž často dochádza k zvýšenému pôsobeniu stresorov, ktoré môžu súvisieť so strachom z diagnózy, obavou o život, strachom z operačného zákroku, straty zárobku, invalidizujúcich následkov ochorenia atď. Stres sa potom môže podieľať na zhoršení spolupráce pacienta s lekárom, znížení efektívnosti terapeutických postupov, spomalení rekonvalescencie a iných negatívnych dôsledkoch. Lekár svojím empatickým prístupom môže výrazne redukovať pôsobenie uvedených stresorov spojených s chorobou, a tým obmedziť ich negatívne pôsobenie na pacienta.
Literatúra
- Bhatia V., Tandon R. K.: Stress and the gastrointestinal tract. J Gastroenterol Hepatol 2005; 20: 332 – 9
- Bhattacharyya M. R., Steptoe A.: Emotional triggers of acute coronary syndromes: strength of evidence, biological processes, and clinical implications. Prog Cardiovasc Dis 2007; 49: 353 – 65
- Hughes V.: Stress: The roots of resilience. Nature 2012; 490: 165 – 7
- Kloner R. A.: Natural and unnatural triggers of myocardial infarction. Prog Cardiovasc Dis 2006; 48: 285 – 300
- Kvetňanský R., Sabban E. L., Palkovits M.: Catecholaminergic systems in stress: structural and molecular genetic approaches. Physiol Rev 2009; 89: 535 – 606
- Miller M. A., Rahe R. H.: Life changes scaling for the 1990s. J Psychosom Res 1997; 43: 279 – 92
- Mravec B.: Autonómny nervový system – súčasť adaptívnych funkcií organizmu. In: I Hulín. Hulínová patofyziológia. Bratislava: SAP, 2009. pp. 1195 – 204
- Mravec B.: Stres a adaptácia. Bratislava: SAP, 2011; 332 s.
- Mysliveček J., Kvetňanský R.: The effects of stress on muscarinic receptors. Heterologous receptor regulation: Yes or no? Auton Autacoid Pharmacol 2006; 26: 235 – 51
- Palkovits M.: Stress-related central neuronal regulatory circuits. In: R McCarty, G Aguillera, EL Sabban, Kvetňanský R.: Stress: Neural, Endocrine and Molecular Studies. London: Taylor and Francis, 2002. pp. 1 – 11
- Selye H.: The Stress of Life. New York: McGraw-Hill, 1984; 516 s.
- Skarlandtová H., Fraňková M., Frynta D., Kittnar O.: Stres a stresové hormony u savců. Cesk Fyziol 2010; 59: 32 – 6
- Tilan J., Kitlinská J.: Sympathetic Neurotransmitters and Tumor Angiogenesis-Link between Stress and Cancer Progression. J Oncol 2010; 2010: 539706
- Yang E. V.: Role for catecholamines in tumor progression: possible use for beta-blockers in the treatment of cancer. Cancer Biol Ther 2010; 10: 30 – 2
- Young J. B., Landsberg L.: Catecholamines and the adrenal medulla. In: JD Wilson, DW Foster, HM Kronenberg, PR Larsen. Williams Textbook of Endocrinology. Philadelphia: W.B. Saunders Company, 1998. pp. 665 – 728












